La Gazette du Canada, Partie I, volume 156, numéro 51 : Règlement modifiant certains règlements pris en vertu de la Loi sur les aliments et drogues (homologation agile)
Le 17 décembre 2022
Fondement législatif
Loi sur les aliments et drogues
Ministère responsable
Ministère de la Santé
RÉSUMÉ DE L’ÉTUDE D’IMPACT DE LA RÉGLEMENTATION
(Le présent résumé ne fait pas partie du Règlement.)
Résumé
Enjeux : Le rythme de l’innovation d’aujourd’hui signifie que les drogues et les instruments médicaux évoluent plus rapidement que les cadres réglementaires traditionnels qui ont été conçus pour les réglementer. De plus, les organismes de réglementation internationaux ont évolué vers une plus grande surveillance après la mise en marché des drogues et des instruments médicaux. Au fil du temps, Santé Canada a adopté des modifications législatives et réglementaires et a mis en œuvre certaines pratiques au moyen de politiques visant à régler ces enjeux. D’autres modifications réglementaires sont nécessaires pour fournir un cadre juridique à l’appui des pratiques stratégiques et pour assurer la transparence, la prévisibilité, l’uniformité et la conformité.
Bon nombre des règlements propres aux médicaments biologiques (produits biologiques) sont trop normatifs et spécifiques aux produits et ne reflètent pas la science et la technologie actuelles. La perspective de l’abrogation des exigences propres aux produits biologiques a souligné la nécessité de préciser les règles et les attentes actuelles en matière de contrôle de la qualité dans le cadre des bonnes pratiques de fabrication (BPF) qui s’appliquent à tous les produits.
Diverses sous-populations, comme les femmes, les minorités raciales, les enfants et les personnes âgées sont souvent sous-représentées dans les données d’essais cliniques, ce qui a une incidence sur la capacité de Santé Canada à déterminer les risques et les différents profils d’innocuité et d’efficacité au sein de diverses sous-populations.
Enfin, les exigences actuelles ne permettent pas aux fabricants de nuancer les limites de pureté et de puissance qui sont différentes de celles des publications énumérées à l’annexe B de la Loi sur les aliments et drogues (la Loi) et qui pourraient être considérées comme acceptables par Santé Canada lorsqu’une norme du fabricant est revendiquée. De plus, les fabricants de certaines drogues sont tenus d’indiquer la norme sur l’étiquette de leur drogue, ce qui est une exigence propre au Canada et a parfois créé des défis pour les fabricants en raison de l’espace limité disponible sur l’étiquette.
Description : Santé Canada propose de nouvelles dispositions ciblées et des modifications réglementaires au Règlement sur les aliments et drogues (RAD) et au Règlement sur les instruments médicaux (RIM) qui permettraient de respecter les engagements du ministère en matière de modernisation et de tirer parti des politiques et des pratiques de longue date. Le projet de réglementation tiendrait compte de l’expérience récente avec les assouplissements réglementaires mis à l’essai avec succès dans le cadre des arrêtés d’urgence liés à la COVID-19 et de leurs transitions vers la réglementation. Le projet comprend des composantes distinctes qui :
- permettraient l’utilisation des conditions sur le numéro d’identification d’une drogue de toute drogue;
- élargiraient la portée de l’utilisation des conditions pour les instruments médicaux de classe II, III et IV;
- exigeraient des plans de gestion des risques (PGR) pour certaines drogues pour usage humain pour permettre de gérer les risques et les incertitudes;
- permettraient l’examen en continu de certaines présentations de drogues, y compris celles de drogues destinées à répondre à une urgence de santé publique;
- clarifieraient les attentes selon lesquelles une drogue doit être fabriquée, emballée et étiquetée, testée et entreposée, y compris pendant le transport, d’une façon qui assure sa qualité;
- moderniseraient les exigences relatives aux produits biologiques en abrogeant les exigences désuètes et en les remplaçant par celles qui tiennent compte des pratiques actuelles;
- clarifieraient, dans la réglementation, le pouvoir d’examiner certains renseignements obtenus à l’extérieur d’une présentation de drogue nouvelle afin d’appuyer l’examen de Santé Canada de cette présentation de drogue nouvelle;
- exigeraient des fabricants qu’ils soumettent des données d’essais cliniques humains ventilées par des sous-groupes de population (données désagrégées) pour les présentations de drogue nouvelle pour usage humain et les suppléments à une présentation de drogue nouvelle pour usage humain, telles qu’elles ont été soumises à la Food and Drug Administration (FDA) des États-Unis ou à l’Agence européenne des médicaments (EMA);
- mettraient à jour les exigences relatives aux normes d’étiquetage et aux exigences pour les fabricants qui revendiquent une norme d’un fabricant pour leur drogue.
Justification : Depuis plusieurs années, Santé Canada participe activement à la modernisation législative et réglementaire afin d’appuyer un cadre de réglementation des drogues et des instruments médicaux qui superviserait plus efficacement les produits réglementés tout au long de leur cycle de vie. La proposition vise à respecter les engagements en matière de modernisation de la réglementation énoncés dans le Secteur de la santé et des sciences biologiques : Examen réglementaire ciblé – Feuille de route réglementaire, qui appuie la réduction des irritants réglementaires et des obstacles à l’innovation en rendant le système de réglementation canadien fondé sur des données scientifiques plus agile et plus harmonisé à l’échelle internationale.
Grâce à l’inclusion des conditions, le Règlement modifiant certains règlements pris en vertu de la Loi sur les aliments et drogues (homologation agile) [le règlement proposé] permettrait au ministre de la Santé (le ministre) de mieux gérer les risques et les incertitudes liés aux drogues et aux instruments médicaux, et de s’adapter à l’innovation et aux changements dans les produits thérapeutiques. L’officialisation dans la réglementation de la pratique de longue date de Santé Canada en ce qui concerne les PGR appuierait mieux l’évaluation de l’information pendant la commercialisation qui pourrait avoir une incidence sur le profil avantages-risques des drogues pour usage humain. Les modifications proposées pourraient faciliter un accès anticipé au marché pour les drogues qui sont admissibles à un examen en continu.
Les exigences en matière de contrôle de la qualité seraient clarifiées en ce qui a trait à toutes les drogues afin de compléter les modifications proposées pour les produits biologiques. Les exigences propres aux produits biologiques seraient remplacées par une réglementation plus large et plus souple qui permettrait de mieux tenir compte des progrès scientifiques et technologiques et de soutenir la pratique actuelle.
Les modifications proposées clarifieraient également dans la réglementation le pouvoir du ministre d’examiner des renseignements et des documents obtenus de sources autres que la présentation, à l’appui de l’examen d’une nouvelle drogue, conformément à la pratique actuelle.
De plus, l’accès à des données désagrégées présentées à la FDA des États-Unis ou à l’EMA améliorerait grandement la capacité de Santé Canada à évaluer l’innocuité et l’efficacité de nouvelles drogues pour usage humain dans certains sous-groupes de la population. Cette étape vers la promotion d’une plus grande diversité dans les essais cliniques souligne l’engagement continu de Santé Canada d’aborder les preuves croissantes des disparités potentielles en matière de santé pour les populations à la recherche d’équité et les populations détentrices de droits, comme les femmes, les minorités raciales et ethniques ou les peuples autochtones, en raison de leur sous-représentation dans les données cliniques.
Enfin, la mise à jour du règlement sur l’étiquetage de la norme pour des drogues spécifiques et des exigences pour certaines drogues qui revendiquent une norme d’un fabricant répondrait aux préoccupations de longue date des fabricants selon lesquelles les exigences actuelles ne sont pas toujours nécessaires pour assurer l’innocuité, l’efficacité et la qualité d’une drogue.
Énoncé des coûts et des avantages : Les coûts supplémentaires pour l’industrie sont estimés à 158 millions de dollars (valeur actualisée [VA]). Il devrait coûter à Santé Canada 26 millions de dollars (VA) pour examiner et gérer les conditions, les examens en continu et les PGR. Par conséquent, le coût total prévu de la modification proposée est de 184 millions de dollars (VA) sur une période de 10 ans, actualisée à 7 %.
Ces coûts seraient compensés par une autorisation de mise en marché plus rapide, une amélioration de la qualité de vie des Canadiens et l’élimination des exigences réglementaires relatives aux normes. Ces avantages sont estimés à 440 millions de dollars (VA) sur une période de 10 ans. L’incidence nette totale prévue de cette proposition est de 256 millions de dollars (VA) en avantages nets.
Règle du « un pour un » et lentille des petites entreprises : La modification proposée est une réduction en ce qui a trait à la règle du « un pour un », car le fardeau administratif prévu pour l’industrie devrait être réduit de 25 177 $ (dollars de 2012) par année, ou de 1 678 $ (dollars de 2012) par entreprise. La lentille des petites entreprises s’applique, car il y a environ 225 petites entreprises au Canada qui pourraient être touchées par cette proposition.
Enjeux
Le rythme de l’innovation aujourd’hui signifie que les drogues et les instruments médicaux évoluent plus rapidement que les cadres réglementaires traditionnels qui ont été conçus pour les accommoder. Par conséquent, le ministre a une capacité limitée d’obliger les fabricants à prendre des mesures pour gérer les risques et les incertitudes associés à une drogue ou à un instrument médical, ou pour tenir compte de différentes façons dans lesquelles l’information relative aux présentations de drogue pourrait être fournie ou obtenue. Bien que Santé Canada ait mis en œuvre certaines pratiques au moyen de politiques visant à régler ces enjeux, il est nécessaire de codifier de telles pratiques et de promouvoir la conformité au moyen de mesures qui assurent la transparence, la prévisibilité et l’uniformité.
En ce qui concerne la fabrication, l’emballage et l’étiquetage, la vérification, l’entreposage et le transport d’une drogue, malgré le fait que le RAD attribue aux services de contrôle de la qualité des responsabilités en ce qui concerne les procédures et les méthodes, il n’y a pas d’exigence claire que de telles activités doivent être menées de manière à maintenir et à assurer la qualité de la drogue. Un exemple des lacunes existantes est l’attente que les drogues doivent être entreposées selon leurs conditions d’entreposage approuvées.
De plus, bon nombre des dispositions relatives aux produits biologiques ne reflètent pas la science actuelle, la technologie et les façons dont l’industrie a évolué au cours des 70 dernières années. Bon nombre des dispositions sont trop prescriptives et spécifiques aux produits et ne sont plus scientifiquement pertinentes. Cela constitue un risque pour la santé et la sécurité des Canadiens que Santé Canada aborde actuellement au moyen de pratiques et de politiques souples et axées sur les résultats.
Lorsqu’il examine une présentation de drogue, afin que le ministre puisse prendre la décision la plus éclairée au sujet de l’autorisation de la drogue, le ministre peut tenir compte des renseignements qui pourraient provenir d’autres sources que la présentation. À l’heure actuelle, les sources d’information explicitement autorisées par la réglementation sont trop limitées et ne comprennent pas les sources clés de matériel et d’information qui pourraient être nécessaires pour que Santé Canada évalue et autorise une nouvelle drogue.
De plus, Santé Canada n’a pas actuellement besoin de recevoir des données désagrégées pour appuyer l’évaluation des présentations de drogues nouvelles ou de suppléments à une présentation de drogue nouvelle. Cependant, la recherche et les données probantes suggèrent qu’il peut y avoir différents profils d’efficacité et d’innocuité pour certaines drogues au sein de diverses sous-populations, y compris celles qui sont fréquemment sous-représentées dans les essais cliniques (par exemple les femmes, les minorités raciales, les enfants et les personnes âgées). La réception de données désagrégées permettrait à Santé Canada de mieux évaluer l’innocuité et l’efficacité d’une drogue au sein de diverses sous-populations et de déterminer si elle peut présenter un risque accru pour une certaine sous-population comparativement à d’autres.
Enfin, dans les cas où une norme d’un fabricant est revendiquée, le RAD ne permet pas aux fabricants de drogues de fixer des limites de pureté et/ou de puissance qui sont différentes de celles des publications énumérées à l’annexe B de la Loi sur les aliments et drogues (la Loi) avec des données supplémentaires qui pourraient être considérées comme acceptables par Santé Canada. Les fabricants ont indiqué que cette exigence a occasionnellement donné lieu au retrait d’une drogue du marché au Canada. De plus, les exigences en matière d’étiquetage relatives à la norme d’une drogue sont propres au Canada (c’est-à-dire qu’elles ne sont pas exigées par d’autres organismes de réglementation, comme la FDA et l’EMA) et ont parfois créé des défis pour certains fabricants en raison de l’espace limité disponible sur l’étiquette.
Contexte
Le ministre de la Santé est responsable des activités réglementaires liées à l’innocuité, à l’efficacité et à la qualité des drogues et des instruments médicaux. Le pouvoir du ministre découle de la Loi et des règlements pris en application de celle-ci, y compris le RAD et le RIM.
Depuis plusieurs années, Santé Canada participe activement à la modernisation législative et réglementaire afin d’appuyer des cadres de réglementation des drogues et des instruments médicaux qui supervisent plus efficacement les produits réglementés tout au long de leur cycle de vie. En 2014, le Parlement a adopté la Loi de Vanessa, qui a modifié la Loi pour inclure les pouvoirs de réglementation aux fins de la collecte de renseignements sur l’innocuité concernant les drogues et les instruments médicaux, aussi appelés produits thérapeutiques, et les pouvoirs qui permettent au ministre de prendre des mesures en cas d’identification d’un risque grave pour la santé. Il s’agissait d’une étape clé de l’initiative de Santé Canada visant à moderniser la Loi et ses règlements connexes régissant les produits thérapeutiques. Les règlements pris en vertu des nouveaux pouvoirs de la Loi de Vanessa ont introduit des mesures qui ont :
- renforcé la surveillance de l’innocuité des produits thérapeutiques tout au long de leur cycle de vie (par exemple les conditions pour les opioïdes et les drogues désignées contre la COVID-19);
- amélioré la surveillance après la mise en marché (par exemple les déclarations obligatoires des réactions graves aux médicaments et des incidents liés aux instruments médicaux par les hôpitaux, les déclarations des mesures réglementaires étrangères comportant un risque grave pour la santé humaine);
- élargi les autorités post-commercialisation pour les instruments médicaux;
- favorisé une plus grande confiance dans la surveillance des produits thérapeutique en augmentant la transparence (par exemple la diffusion publique de renseignements sur les essais cliniques);
- harmonisé les exigences avec celles des organismes de réglementation d’autres administrations.
D’autres travaux sur la détermination et la réponse aux irritants réglementaires et aux obstacles à l’innovation ont été menés dans le cadre de l’examen sectoriel de la réglementation du secteur de la santé et des sciences biologiques de 2019 et ont abouti au lancement du programme d’innovation de la réglementation de Santé Canada. Grâce à ces initiatives, Santé Canada s’est engagé à moderniser les règlements applicables afin d’offrir au bout du compte des cadres réglementaires modernes et souples pour les drogues et les instruments médicaux.
Certaines de ces souplesses (conditions et examens en continu) ont été mises à l’essai dans le cadre de la réponse à la pandémie de COVID-19 au moyen des projets réglementaires suivants :
- l’Arrêté d’urgence concernant l’importation, la vente et la publicité de drogues à utiliser relativement à la COVID-19 (septembre 2020), suivi des modifications au RAD (mars 2021);
- trois arrêtés d’urgence concernant l’importation et la vente d’instruments médicaux à utiliser en regard à la COVID-19 (mars 2020, mars 2021, février 2022).
Cette initiative réglementaire fait partie du programme d’innovation de la réglementation de Santé Canada et contribuera directement à la Stratégie en matière de biofabrication et de sciences de la vie du gouvernement qui reconnaît l’importance du système de réglementation en tant que catalyseur de la croissance du secteur national de la biofabrication.
Conditions
Le rythme rapide de l’innovation de l’industrie a entraîné des incertitudes et des risques en ce qui concerne les produits thérapeutiques qui pourraient ne pas être gérés adéquatement au moyen des dispositions réglementaires existantes. Une condition est une obligation que le ministre peut imposer au titulaire d’une autorisation de produit thérapeutique de mener une activité à l’égard de la drogue ou de l’instrument médical visé par l’autorisation. L’objectif principal des conditions est d’optimiser les avantages et de gérer les risques et les incertitudes associés à la drogue ou à l’instrument médical, y compris en recueillant des renseignements supplémentaires après son autorisation. Santé Canada reconnaît depuis longtemps la valeur d’une telle approche. En 1998, la politique sur les Avis de conformité avec conditions (AC-C) a été mise en place pour permettre aux fabricants de certaines drogues pour usage humain — à savoir, celles destinées à traiter une maladie ou une affection grave qui met en danger la vie ou est sévèrement débilitante — de demander une autorisation de vendre une drogue en fonction des preuves cliniques prometteuses qui indiquent que son utilisation est raisonnablement susceptible de produire le résultat voulu. Cette politique a permis à Santé Canada de gérer plus efficacement les incertitudes liées aux risques et aux avantages et, par conséquent, de faciliter une mise sur le marché plus rapide des drogues pouvant sauver des vies lorsque le fabricant accepte d’entreprendre des études plus poussées pour confirmer l’efficacité et surveiller l’innocuité de ces drogues et fournir cette information au ministre après son entrée sur le marché canadien.
À l’heure actuelle, le ministre a un vaste pouvoir d’imposer ou de modifier les conditions relatives aux opioïdes et aux drogues désignées contre la COVID-19 dans le RAD. Depuis l’entrée en vigueur du RIM en 1998, le ministre a obtenu le pouvoir d’imposer ou de modifier les conditions relatives à la vérification sur les licences d’instruments médicaux de classe II, III et IV. De plus, de grands pouvoirs en matière de conditions ont été inclus dans les arrêtés d’urgence liés à l’autorisation d’instruments médicaux destinés à être utilisés à l’égard de la COVID-19.
Plans de gestion des risques
Un PGR résume les risques et les incertitudes cernés et potentiels liés à une drogue et aux activités de pharmacovigilance connexes, ainsi que les autres mesures que le fabricant a l’intention de mettre en place pour gérer ces risques et incertitudes.
À l’échelle internationale, la plupart des organismes de réglementation des drogues pour usage humain, y compris ceux de l’Union européenne, du Royaume-Uni et des États-Unis, ont introduit des exigences prévues par la loi pour les PGR ou leur équivalent. Depuis 2009, afin de mieux s’harmoniser avec la pratique internationale, Santé Canada a demandé aux fabricants de présenter volontairement des PGR au moment du dépôt d’une présentation de drogue nouvelle pour certaines nouvelles substances activesréférence 1. En 2015, Santé Canada a publié la Ligne directrice – Présentation des plans de gestion des risques et des engagements en matière de suivi qui formaliseraient la pratique de demander des PGR aux fabricants de :
- produits pharmaceutiques (y compris ceux vendus sur ordonnance et ceux en vente libre) qui comprennent de nouvelles substances actives;
- produits biologiques (y compris les produits biotechnologiques, les vaccins ainsi que les produits sanguins obtenus par fractionnement) conformément à l’annexe D de la Loi;
- produits pharmaceutiques radioactifs tels qu’ils sont énoncés à l’annexe C de la Loi.
La ligne directrice indique que les fabricants devraient inclure des sections propres au Canada qui aborderaient les facteurs applicables à la population canadienne, selon le contexte et le marché canadiens.
Examens en continu
Un « examen en continu » permet à un fabricant de soumettre sa présentation de drogue avec certains, mais pas tous les renseignements nécessaires pour que l’organisme de réglementation puisse évaluer l’innocuité et l’efficacité d’une drogue. Pourvu que certaines conditions soient respectées, une telle présentation peut être déposée, étant entendu que les renseignements manquants devraient être fournis dans un délai raisonnable. Toutefois, peu importe la quantité de renseignements qui est incluse au moment du dépôt de la présentation, la décision d’autoriser la drogue ne peut être prise que lorsque tous les renseignements requis, y compris les renseignements manquants, ont été fournis et jugés acceptables.
Santé Canada a utilisé des examens en continu pour accroître l’accès en temps opportun aux médicaments nécessaires. Actuellement, des examens en continu sont disponibles par pratique pour les mises à jour annuelles des vaccins contre la grippe saisonnière ainsi que pour l’examen simultané des présentations de drogue pour usage vétérinaire avec les États-Unis dans le cadre du Conseil de coopération Canada–États-Unis en matière de réglementation. Des examens en continu sont également disponibles dans le RAD pour les présentations de drogue nouvelle pour des drogues désignées contre la COVID-19 tel qu’il est modifié par le Règlement modifiant le Règlement sur les aliments et drogues (Arrêté d’urgence concernant l’importation, la vente et la publicité de drogues à utiliser relativement à la COVID-19).
Assurer la qualité des médicaments pendant la fabrication
Les BPF sont un système d’assurance de la qualité reconnu à l’échelle internationale qui permet de s’assurer que les drogues sont fabriquées, emballées, étiquetées, analysées, importées, distribuées et vendues en gros de façon uniforme. Toutefois, bien qu’il soit prévu que les drogues soient fabriquées, emballées, étiquetées, analysées et entreposées, y compris pendant le transport, d’une manière qui assurerait la qualité de l’ingrédient actif et de la drogue sous forme posologique, cela n’est pas clairement énoncé dans les textes réglementaires.
Modernisation des exigences relatives aux produits biologiques
Les produits biologiques sont fabriqués et extraits de tissus ou d’organismes vivants, certains avec des gènes modifiés. Leur innocuité et leur efficacité dépendent grandement de leurs matériaux sources (par exemple les cellules, les organismes vivants) et des matériaux auxiliaires (par exemple les additifs utilisés pour compléter le milieu de culture cellulaire). De plus, les produits biologiques ont tendance à être des solutions stériles et injectables qui traitent des affections graves ou mettant en danger la vie, et les risques liés à ces drogues peuvent être tout aussi graves ou mettre en danger la vie.
Une grande partie du titre 4 de la partie C du RAD consiste en des règlements propres aux produits qui ont été adoptés dans les années 1950 et 1960 pour répondre aux questions de l’époque. Étant donné que le nombre de produits biologiques a considérablement augmenté au fil du temps et que les règlements ont toujours été essentiellement axés sur les produits, ils n’ont pas suivi le rythme des progrès scientifiques.
Des modifications importantes ont été apportées en 1997 afin de fusionner les exigences relatives aux licences d’établissement pour la fabrication de médicaments pharmaceutiques, de produits biologiques et de produits pharmaceutiques radioactifs dans le titre 1A du RAD. Bien que ces modifications aient introduit des inspections de BPF liées aux locaux, au personnel, aux processus et aux produits, Santé Canada a maintenu, en vertu de la politique, la capacité d’utiliser les renseignements obtenus sur place, afin de confirmer la capacité du fabricant à produire régulièrement un produit biologique sûr et à vérifier les renseignements fournis dans la présentation connexe.
Renseignements à l’appui de l’examen des présentations de drogue
Conformément à la pratique susmentionnée, Santé Canada utilise l’information provenant de diverses sources, y compris les évaluations sur place (ESP) et les inspections de BPF, dans l’examen d’une présentation de drogue, afin d’évaluer l’innocuité et l’efficacité de la drogue. Santé Canada examine actuellement les renseignements et les documents disponibles, y compris ceux obtenus à l’extérieur de la présentation, afin de prendre une décision éclairée quant à l’autorisation d’une drogue pour le marché canadien.
Données désagrégées relatives aux essais cliniques pour les présentations de drogue nouvelle pour usage humain et les suppléments à une présentation de drogue nouvelle pour usage humain
La collecte de données désagrégées sur les participants aux essais cliniques est une mesure clé que Santé Canada peut prendre pour d’abord évaluer et, au besoin, traiter tout risque et avantage divergents des drogues dans diverses sous-populations. Santé Canada accorde de l’importance à l’élaboration et à la conduite d’essais cliniques inclusifs, particulièrement pour les populations sous-représentées. Les demandes présentées à Santé Canada comportent généralement un certain degré de données démographiques désagrégées; toutefois, elles ne reflètent pas toujours le nombre de patients ou ne sont pas ventilées par sous-groupes de population (par exemple âge, sexe, genre ou race).
Normes
Les normes sur les drogues comprennent des critères et des méthodes d’essai qui aident à assurer la qualité d’une drogue. Ces normes peuvent être prescrites par règlement, définies dans une pharmacopéeréférence 2 inscrite à l’annexe B de la Loi ou élaborées par le fabricant de la drogue. Si une norme n’a pas été prescrite par règlement, mais qu’elle figure dans une pharmacopée inscrite à l’annexe B de la Loi, un fabricant peut utiliser la norme de la pharmacopée ou sa propre norme de fabricant. Si la norme du fabricant est utilisée, le RAD exige que la drogue respecte le degré maximal de pureté et la variation de puissance la plus petite pour cette drogue de toutes les pharmacopées inscrites à l’annexe B. Cela s’applique à toutes les drogues, y compris les ingrédients actifs, réglementés en vertu des titres 1, 3, 4 ou 8 de la partie C du RAD tout au long de leur cycle de vie. Cette exigence prescriptive ne permet pas à ceux qui prétendent une norme du fabricant de justifier scientifiquement des contrôles plus étendus de pureté et de puissance qui pourraient également être acceptables pour le ministre.
Pour les drogues réglementées en vertu des titres 1 ou 8 du RAD, le Règlement exige actuellement que les étiquettes intérieure et extérieure indiquent si le fabricant a utilisé une norme prescrite dans le RAD, une norme de l’annexe B (par exemple la U.S. Pharmacopeia) ou une norme du fabricant. L’inclusion de cette information est une exigence propre au Canada et a parfois créé des défis pour les fabricants en raison de l’espace limité disponible sur l’étiquette.
Objectif
L’objectif des modifications réglementaires proposées est d’accroître la souplesse réglementaire pour suivre le rythme de l’innovation et faciliter l’accès à des traitements de pointe et à des thérapies prometteuses, tout en continuant de s’assurer que les drogues autorisées et les instruments médicaux homologués sont sûrs, efficaces et assujettis à une surveillance appropriée.
Description
Ces modifications réglementaires proposées introduiraient une série de changements ciblés au RAD et au RIM qui reflètent les politiques existantes ainsi que les expériences récentes de Santé Canada avec les arrêtés d’urgence relatifs à la COVID-19.
Conditions — drogues et instruments médicaux (modifications au RAD et au RIM)
Les modifications proposées permettraient au ministre d’imposer des conditions sur l’identification numérique de drogue de toute drogue ou sur la licence d’un instrument médical de classe II, III ou IV au moment de la délivrance de l’homologation ou à tout moment ultérieur. Les conditions pourraient également être modifiées ou supprimées en tout temps, au besoin. Bien que le RIM permette actuellement au ministre d’imposer des conditions relatives aux essais sur les licences d’instruments médicaux de classe II, III ou IV, les modifications proposées élargiraient la portée des conditions qui peuvent être imposées et leur permettraient d’être exécutoires en vertu de l’article 21.7 de la Loi.
Avant d’imposer ou de modifier les conditions, le ministre déterminerait si les conditions contribuent à l’atteinte des objectifs de gestion des incertitudes liées aux avantages et aux risques, d’optimisation des avantages et de gestion des risques, et de détermination des changements liés aux avantages et aux risques de la drogue ou de l’instrument médical.
De plus, le ministre se demanderait si les conditions sont techniquement réalisables, s’il existe des moyens moins lourds d’atteindre ces objectifs et si elles pourraient être atteintes par l’application des exigences existantes en vertu de la Loi ou du RAD et du RIM, selon le cas.
Toutes les présentations de drogues doivent avoir les renseignements et les données nécessaires pour établir l’innocuité, l’efficacité et la qualité d’une drogue afin de démontrer un profil avantages/risques favorable et de satisfaire à toutes les exigences en vertu du RAD pour l’autorisation de mise en marché. L’objectif général de l’imposition des conditions serait de veiller à ce qu’une drogue maintienne un profil avantages/risques favorable tout au long de son cycle de vie et à ce que l’innocuité, l’efficacité ou la qualité de la drogue n’ait pas changé par rapport au moment où l’autorisation de mise sur le marché a été délivrée.
Les conditions pourraient, par exemple, être appliquées afin de :
- gérer les incertitudes liées aux avantages et/ou aux risques cernés au moment de leur délivrance (par exemple demander des études pour confirmer les avantages d’une drogue ou d’un instrument médical, y compris dans les sous-populations, au besoin);
- gérer les risques ou les incertitudes émergents qui ont fait surface après la mise en marché et qui n’ont peut-être pas été cernés avant l’autorisation;
- recueillir des données pour être en mesure d’identifier et d’évaluer les changements potentiels à l’innocuité et/ou à l’efficacité et de gérer les incertitudes (par exemple pour les nouvelles technologies ou les nouvelles indications d’utilisation);
- exiger que le titulaire d’une licence d’instrument médical apporte des changements à l’instrument médical afin de continuer à maintenir l’innocuité et l’efficacité.
Initialement, dans le cas des drogues, les modifications proposées seraient limitées à toute drogue d’urgence de santé publique, c’est-à-dire une drogue contre la COVID-19 ou une condition décrite dans la Liste d’affections qui menacent la santé publique au Canada, qui serait incorporée par référence. Toutefois, un an après l’enregistrement du projet de règlement, ces dispositions limitées seraient abrogées et les modifications proposées concernant les conditions pour toutes les drogues entreraient en vigueur. Les modifications proposées concernant les conditions pour les instruments médicaux de classe II, III et IV entreraient également en vigueur à ce moment-là.
Plans de gestion des risques (modifications au RAD)
Les modifications proposées refléteraient la pratique de longue date de Santé Canada énoncée dans la ligne directrice intitulée Présentation des plans de gestion des risques et des engagements en matière de suivi. Le règlement exigerait qu’un PGR soit déposé avec une demande d’identification numérique de drogue, une présentation de drogue nouvelle ou d’une présentation de drogue nouvelle abrégée pour une drogue pour usage humain si le ministre a des motifs raisonnables de croire qu’il y a un degré d’incertitude important à l’égard des risques associés à la drogue, ou si la drogue présente un risque grave de préjudice à la santé humaine qui justifie la prise de mesures au-delà des changements apportés à l’étiquette, afin de réduire la possibilité ou la gravité d’un tel préjudice. Les PGR seraient requis pour toutes les présentations de drogues nouvelles pour usage exceptionnel.
Les modifications conféreraient également au ministre le pouvoir réglementaire d’exiger un PGR pour une drogue pour usage humain autorisée à l’égard de laquelle un PGR n’a pas encore été fourni lorsque les circonstances décrites ci-dessus se présentent.
De plus, le titulaire de l’autorisation serait tenu de fournir au ministre un PGR mis à jour si le PGR mis à jour est considérablement différent du PGR soumis antérieurement, ou si le ministre a des motifs raisonnables de croire qu’un PGR mis à jour est requis pour répondre à des différences importantes dans :
- les risques et les incertitudes associés à la drogue;
- les mesures justifiées pour gérer un risque grave de préjudice à la santé humaine.
Pour appuyer la transparence réglementaire, les modifications créeraient également une nouvelle obligation pour les fabricants de soumettre un résumé des PGR nouveaux et mis à jour dans les deux langues officielles. En pratique, ces résumés seraient publiés en ligne et leur contenu serait harmonisé avec celui d’autres administrations avec l’ajout de contenu canadien requis, le cas échéant.
Les modifications proposées relatives aux PGR ne s’appliqueraient pas aux médicaments vétérinaires.
Examens en continu (modifications au RAD)
Les modifications proposées introduiraient un certain nombre d’options d’examen en continu dans le règlement pour les présentations de drogues nouvelles et les suppléments à une présentation de drogue nouvelle dans les cas suivants :
- la nouvelle drogue répond à certaines conditions décrites ci-dessous;
- la drogue est un médicament vétérinaire et le ministre a indiqué son intention de mener l’examen avec un organisme de réglementation étranger;
- la souche à laquelle se rapporte un vaccin contre la grippe, figurant sur une liste incorporée par renvoi, a changé;
- la drogue est liée à une condition qui menace la santé publique figurant sur une liste incorporée par renvoi.
Ces options auraient pour effet de fournir aux fabricants qui demandent un avis de conformité (AC) des exigences modifiées relatives à la présentation de renseignements au moment du dépôt. Toute information manquante nécessaire pour évaluer l’innocuité et l’efficacité de la drogue doit être fournie dans un délai raisonnable afin de permettre à Santé Canada de prendre une décision au sujet de l’émission d’un AC. Toutes les autres exigences du RAD, comme la conservation des dossiers et la protection des données, ainsi que les régimes de propriété intellectuelle en vertu de la Loi sur les brevets, s’appliqueraient également aux présentations et aux drogues qui font l’objet d’un examen en continu.
Drogues qui répondent à certaines conditions
Le règlement proposé créerait un nouveau processus facultatif pour les présentations de drogue nouvelle et pour les suppléments aux présentations de drogue nouvelle afin de faciliter l’accès en temps opportun à de nouvelles drogues qui répondent à une ou plusieurs des conditions suivantes :
- les médicaments pour usage humain et vétérinaire nécessaires pour lutter contre les maladies infectieuses émergentes qui posent ou peuvent poser un risque grave de préjudice à la santé;
- les médicaments pour usage humain et vétérinaire destinés au traitement, à la prévention, à l’atténuation ou au diagnostic de maladies ou d’affections graves lorsque :
- l’objectif et les conditions d’utilisation recommandés de la nouvelle drogue ne sont pas conformes à l’objectif et aux conditions d’utilisation recommandés de toute autre drogue pour laquelle une identification numérique de drogue a été attribuée et n’a pas été annulée,
- la nouvelle drogue est beaucoup plus efficace, ou possède un risque beaucoup plus faible, comparativement à toutes les autres drogues pour les mêmes fins et les mêmes conditions d’utilisation recommandées pour lesquelles une identification numérique de drogue a été attribuée et n’a pas été annulée.
Une évaluation préalable à la présentation visant à déterminer l’admissibilité d’un examen en continu lorsque la nouvelle drogue satisfait à une ou plusieurs des conditions ci-dessus exigerait que le fabricant :
- fournisse à Santé Canada des renseignements qui démontrent que la drogue proposée satisfait à une ou plusieurs des conditions décrites ci-dessus et que le fabricant possède une quantité importante de preuves pour établir l’innocuité et l’efficacité clinique de la drogue aux fins et aux conditions d’utilisation recommandées;
- fournisse un plan qui précise comment et quand, dans les 155 jours suivant le dépôt de la présentation, il soumettra toute information manquante. Le plan devrait envisager de fournir les renseignements manquants dans quelques transactions.
S’il est déterminé que la présentation de drogue proposée, pour laquelle une évaluation préalable à la présentation a été effectuée, est admissible à un examen en continu, le fabricant serait avisé par le ministre. L’avis indiquerait une date limite de 60 jours suivant la date à laquelle l’avis est émis par le ministre pour fournir la présentation, ainsi que la façon et le moment où les renseignements manquants doivent être fournis.
Afin de permettre à Santé Canada de commencer l’examen de ces présentations de drogues, les modifications proposées établiraient également des exigences minimales en matière d’information qui doivent être respectées au moment du dépôt de la présentation, y compris que la présentation doit, au moment du dépôt, inclure une quantité importante de renseignements pour permettre au ministre de commencer à évaluer l’innocuité et l’efficacité de la drogue. Au moment du dépôt, une présentation de drogue faisant l’objet d’un examen en continu doit également comprendre tous les renseignements normalement requis concernant la formulation, l’ingrédient médicinal, l’utilisation et la forme posologique de la drogue.
En ce qui concerne une présentation de drogue nouvelle, les renseignements qui pourraient être fournis à la suite de la transaction initiale comprendraient certains renseignements manquants concernant les tests et les preuves permettant d’établir l’innocuité et l’efficacité de la nouvelle drogue, des renseignements concernant les chercheurs auxquels la nouvelle drogue a été vendue, des preuves que les lots d’essai de la nouvelle drogue ont été fabriqués d’une façon qui est représentative de la production commerciale, le délai d’attente de la nouvelle drogue chez les animaux destinés à l’alimentation, un plan de gestion des risques et tout résumé et rapport de section pour toute étude qui n’est pas encore achevée. En ce qui concerne un supplément à une présentation de drogue nouvelle, qui se limite à des questions sensiblement différentes par rapport à la présentation originale, l’option d’un examen en continu exigerait qu’une quantité importante des renseignements soit fournie dans la transaction initiale. Cependant, cette option permettrait la soumission subséquente de toute information manquante dont le ministre a besoin pour évaluer l’innocuité et l’efficacité de la nouvelle drogue, ainsi que tout résumé et rapport de section pour toute étude qui n’est pas encore achevée.
Tous les renseignements normalement requis relativement à une présentation de drogue devraient être fournis avant que le ministre puisse terminer l’examen de la présentation. La date de dépôt d’une présentation admissible à un examen en continu serait la date à laquelle la présentation est jugée administrativement complète par Santé Canada (c’est-à-dire une fois que tous les éléments et formulaires requis pour le traitement sont remplis et ont été soumis). Cette date peut différer de la date de réception de la transaction initiale, si la soumission est considérée comme administrativement incomplète à ce moment. Une fois établie, la date de dépôt ne change pas, même si, dans le cas d’un examen en continu, le fabricant fournit par la suite à Santé Canada les renseignements manquants.
Drogues déjà assujetties à un examen en continu selon la politique actuelle
En plus des options d’examen en continu susmentionnées, conformément à la politique actuelle, les présentations de médicaments vétérinaires pour lesquelles le ministre a indiqué son intention de mener l’examen avec un organisme de réglementation étranger et les suppléments à une présentation de drogue nouvelle pour lesquelles un changement a été apporté à la souche à laquelle se rapporte un vaccin antigrippal (par exemple les présentations concernant les mises à jour annuelles des vaccins contre la grippe saisonnière) seraient également admissibles à un examen en continu. Les vaccins antigrippaux admissibles à cette option d’examen en continu seraient définis dans une liste incorporée par renvoi. Cette liste serait élaborée, révisée et maintenue conformément aux principes directeurs énoncés dans la Politique d’incorporation par renvoi de Santé Canada. Afin de s’harmoniser avec la pratique actuelle, les exigences pour ces deux options d’examen en continu seraient différentes. Par exemple, ces présentations ne seraient pas assujetties à une évaluation préalable à la présentation.
À l’exception des examens en continu des présentations où il y a eu un changement à la souche à laquelle un vaccin contre la grippe se rapporte, les modifications proposées pour les options d’examen en continu décrites ci-dessus permettraient également au ministre, dans certaines conditions, d’annuler la présentation. Par exemple, dans le cas des examens en continu de nouvelles drogues qui sont conformes aux conditions décrites dans la section ci-dessus, lorsque le fabricant a omis, ou serait incapable, de fournir les renseignements manquants dans un délai raisonnable après la date pertinente précisée dans l’avis, l’examen serait terminé et la présentation serait considérée comme annulée par le fabricant. Si un fabricant choisit de déposer une nouvelle présentation pour la même drogue auprès de Santé Canada après une telle annulation, une nouvelle date de dépôt serait assignée une fois que la nouvelle présentation est jugée administrativement complète.
Drogues d’urgence de santé publique
Enfin, les dispositions existantes du RAD concernant les activités réglementées en vertu du titre 1A liées à la COVID-19 et l’autorisation de mise sur le marché des drogues contre la COVID-19, y compris l’option d’un examen en continu, seraient élargies pour s’appliquer à toute drogue d’urgence de santé publique en relation avec une condition mentionnée dans la Liste d’affections qui menacent la santé publique, qui serait incorporée par renvoi. Une drogue d’urgence de santé publique serait définie comme une nouvelle drogue dont le but et les conditions d’utilisation recommandées par le fabricant se rapportent à la COVID-19 ou à une affection décrite dans la liste. Afin d’ajouter des affections à la liste, le ministre devrait avoir des motifs raisonnables de croire que l’affection présente un risque important pour la santé publique au Canada ou en résulte, et des mesures immédiates sont nécessaires pour faire face au risque. La proposition de dresser une liste qui serait incorporée par renvoi permettrait au ministre de répondre à une urgence de santé publique d’une manière opportune et souple. La liste serait élaborée, examinée et tenue à jour conformément aux principes directeurs énoncés dans la Politique d’incorporation par renvoi de Santé Canada.
À l’appui de l’élargissement de l’option actuelle d’examen en continu de la COVID-19 aux urgences de santé publique, les critères de prépositionnement d’une drogue seraient également élargis pour inclure une drogue d’urgence de santé publique afin de permettre une réponse à une affection mentionnée dans la liste. Le règlement serait également modifié pour permettre l’importation seulement si le titulaire de la licence d’établissement de produits pharmaceutiques est un importateur autorisé et que la drogue d’urgence de santé publique fait partie de la même catégorie de drogue que celle autorisée par la licence.
Assurer la qualité des drogues pendant la fabrication (modifications au RAD)
Les modifications proposées clarifieraient les attentes selon lesquelles une drogue doit être fabriquée, emballée et étiquetée, testée et entreposée, y compris entreposée pendant le transport, d’une manière qui assure la qualité de la drogue.
Cette exigence est censée s’appliquer à tous les fabricants, emballeurs/étiqueteurs, testeurs et grossistes autorisés, ainsi qu’aux importateurs et distributeurs canadiens. La nouvelle disposition C.02.012.1 vise à collaborer avec les autres exigences du titre 2 du RAD et ne modifie pas les attentes actuelles pour toutes les drogues.
Modernisation des exigences concernant les médicaments biologiques (modifications au RAD)
La modernisation du titre 4 de la partie C du RAD envisage de supprimer les règlements désuets spécifiques à certains produits biologiques et de les remplacer par des exigences plus générales qui reflètent les objectifs de sécurité sous-jacents, tels qu’ils s’appliquent à la ligne directrice et à la pratique actuelles. Les dispositions qu’on envisage d’abroger et de remplacer sont des dispositions propres à un produit allant de C.04.050 à C.04.683. Par conséquent, les définitions de « date de fabrication » et « date de sortie » ne seraient plus nécessaires et n’apparaîtraient pas dans le nouveau titre 4.
La modernisation proposée serait mise en œuvre de façon à réduire au minimum l’incidence sur les fabricants de produits biologiques actuellement commercialisés en reconnaissant et en appuyant les pratiques actuelles. Plus précisément, on ne s’attend pas à ce que les modifications proposées au RAD modifient les pratiques actuelles, y compris celles relatives à l’autorisation de mise en circulation de lots et aux ESP.
Contrôles sur la fabrication des produits biologiques
Les modifications proposées tiennent compte de la pratique actuelle et remplaceraient les exigences normatives concernant le matériel biologique de départ et le matériel auxiliaire utilisés dans la fabrication de produits biologiques par des règlements plus souples et axés sur les résultats qui maintiennent un niveau approprié de surveillance en matière d’innocuité. Les matériels d’origine biologique ont été définis de manière à inclure les matières premières biologiques, les matériels d’origine biologique de départ et les matériels auxiliaires. Les exigences relatives à la fabrication et à la collecte de produits biologiques ont été clarifiées afin de s’appliquer également aux matériels d’origine biologique.
Il est proposé de généraliser les règlements existants qui contrôlent la contamination des produits biologiques afin de s’assurer que le personnel de production ne contribue pas au risque de contamination des matériels d’origine biologique par des agents infectieux. Les modifications proposées supprimeraient certaines dispositions relatives aux exigences en matière de personnel, d’entreposage et de transport, car elles sont désuètes, et le Ministère se fonderait plutôt sur les règlements correspondants du titre 2 (Bonnes pratiques de fabrication) de la partie C du RAD.
Normes sur les produits biologiques
Les normes individuelles sur les produits biologiques, comme l’insuline, qui sont prescrites au titre 4, sont dépassées par les changements scientifiques et ne sont pas actuellement utilisées par les fabricants ou Santé Canada. L’intention est de remplacer ces normes prescrites et de continuer à évaluer les spécifications fournies par le fabricant pendant l’examen de la présentation. De plus, les modifications proposées exigeraient que les préparations de référence utilisées pour évaluer la pureté ou la puissance d’une drogue, selon le cas, soient suffisantes pour contrôler la qualité du produit.
Mise en circulation de lots de produits biologiques
Les dispositions à l’appui du Programme de mise en circulation de lots seraient modifiées pour mieux appuyer une approche échelonnée et fondée sur les risques, conformément à la Ligne directrice à l’intention des promoteurs : Programme d’autorisation de mise en circulation des lots de drogues visées à l’annexe D (produits biologiques) et la pratique actuelle.
Pour gérer les risques associés aux lots individuels, les modifications proposées permettraient au ministre de demander des renseignements, des échantillons ou d’autres documents, au besoin, y compris pour effectuer des essais indépendants. Lorsqu’une demande a été faite, personne ne serait autorisé à vendre une drogue de ce lot tant que le ministre ne l’aura pas avisée que le lot peut être vendu.
Les modifications proposées officialiseraient également dans la réglementation la pratique discrétionnaire actuelle de fournir des rapports annuels sur les produits biologiques. Ces rapports caractérisent la qualité de la drogue et de ses ingrédients actifs, ainsi que la régularité de leurs procédés de fabrication et d’emballage au cours de la période écoulée depuis le dernier rapport. Les exigences proposées comprendraient des rapports périodiques sur la qualité, sur une base annuelle ou plus longtemps, tel qu’il est précisé par le ministre.
Étiquetage de produits biologiques
Les modifications proposées mettraient à jour certaines exigences en matière d’étiquetage pour les produits biologiques afin de les harmoniser avec les exigences du titre 1 de la partie C du RAD. Il s’agit notamment de la souplesse d’étiquetage des petits continents qui ont une étiquette extérieure.
En plus des directives d’utilisation adéquates, le règlement proposé exigerait sur l’étiquette une déclaration indiquant les conditions d’entreposage approuvées et des renseignements supplémentaires, au besoin, pour prévenir un préjudice à la santé du consommateur ou du patient (par exemple multidose, usage pédiatrique, groupe d’âge, avertissement, etc.).
Les étiquettes des produits biologiques devraient indiquer si la drogue provient directement d’une source humaine ou d’une source animale et devraient préciser l’espèce d’origine.
Les modifications proposées permettraient aux fabricants de produits biologiques entreposés par des ministères ou des organismes gouvernementaux pour être utilisés dans des situations d’urgence, lorsqu’on prévoit que la drogue sera entreposée pendant des périodes prolongées et que le programme d’évaluation de la stabilité à long terme est en cours, d’indiquer la date d’expiration par d’autres moyens que par une déclaration sur l’étiquette de l’emballage. Les autres moyens d’indiquer la date d’expiration devraient être facilement accessibles à la personne qui administre la drogue et jugée acceptable par le ministre.
Toutes ces modifications proposées à l’étiquetage sont conformes aux pratiques actuelles et ne devraient donc pas avoir d’incidence sur les étiquettes approuvées.
Renseignements à l’appui de l’examen des présentations de drogue (modifications au RAD)
Conformément à la pratique actuelle, la modification proposée à la disposition C.08.003.1 clarifierait le pouvoir du ministre d’examiner des renseignements ou du matériel qui pourraient être examinés au cas par cas en fonction des risques au cours de l’évaluation d’une présentation de drogue par Santé Canada. Le ministre pourrait examiner des renseignements et du matériel :
- fournis au ministre par toute personne en vertu de la Loi;
- obtenus d’un immeuble ou d’un site où une drogue est fabriquée, emballée, étiquetée ou analysée (par exemple évaluations sur place pour les produits biologiques, inspection des BPF);
- obtenus d’une autorité de réglementation étrangère (par exemple rapports d’examen étrangers, rapports d’inspection étrangers).
La disposition mise à jour n’a pas pour but de modifier l’obligation du fabricant de fournir suffisamment d’information à l’appui de la présentation. Les dispositions relatives à la protection des données du RAD et le Règlement sur les médicaments brevetés (avis de conformité) continueraient de s’appliquer, même lorsque des renseignements sont pris en considération en vertu de la disposition C.08.003.1.
Données désagrégées relatives aux essais cliniques pour les présentations de drogue nouvelle pour usage humain et les suppléments à une présentation de drogue nouvelle pour usage humain (modifications au RAD)
Les modifications proposées obligeraient les fabricants à soumettre des données d’essais cliniques humains ventilées en sous-groupes de population pour appuyer l’innocuité et l’efficacité de la présentation de drogue nouvelle (ou un supplément), si les données désagrégées ont déjà été soumises à la FDA ou à l’EMA. Il s’agit d’une étape importante à mesure que Santé Canada va de l’avant avec une approche progressive en ce qui concerne les exigences supplémentaires en matière de désagrégation de données.
Normes (modifications au RAD)
L’exemption réglementaire proposée concernant les normes exclurait les nouvelles drogues qui sont réglementées en vertu du titre 8 de la partie C du RAD, autres que celles de l’annexe C (produits pharmaceutiques radioactifs), d’avoir à respecter les normes les plus strictes de pureté et de puissance de toutes les pharmacopées de l’annexe B dans lesquelles se trouve l’ingrédient actif ou la drogue, lorsque le fabricant revendique une norme d’un fabricant. En raison de leurs caractéristiques intrinsèques uniques et de leur profil de biodistribution sensible qui, en fin de compte, ont une incidence sur leur index thérapeutique et diagnostique, les drogues de l’annexe C continueraient d’être tenues de respecter les normes les plus strictes en matière de pureté et de puissance de toutes les pharmacopées de l’annexe B lorsqu’une norme du fabricant est revendiquée.
Les drogues qui ne sont pas de nouvelles drogues continueraient d’être assujetties aux exigences actuelles.
Pour les drogues réglementées uniquement en vertu du titre 1 et celles réglementées en vertu du titre 8 qui ne sont pas également réglementées en vertu des titres 3 et 4 (c’est-à-dire les produits pharmaceutiques radioactifs et biologiques), les modifications proposées élimineraient l’exigence selon laquelle la norme utilisée pour la drogue doit être indiquée sur l’étiquette de l’emballage.
Entrée en vigueur
Les modifications réglementaires proposées suivantes, qui accordent la priorité à la réduction du fardeau pour l’industrie et font en sorte que Santé Canada soit bien placé pour faire face à toute urgence de santé publique future, entreraient en vigueur au moment de l’enregistrement :
- les modifications relatives aux drogues d’urgence de santé publique (y compris les conditions, les examens en continu et le prépositionnement);
- assurer la qualité des drogues pendant la fabrication;
- la modernisation des exigences concernant les produits biologiques;
- les renseignements à l’appui de l’examen des présentations de drogue;
- les données désagrégées relatives aux essais cliniques pour les présentations de drogues nouvelles pour usage humain et les suppléments à une présentation de drogue nouvelle pour usage humain;
- les normes.
Les modifications réglementaires proposées suivantes, qui nécessitent un délai supplémentaire pour être mises en œuvre, entreraient en vigueur un an après l’enregistrement :
- les conditions (pour toutes les drogues et les instruments médicaux de classe II, III et IV);
- les plans de gestion des risques;
- les examens en continu (pour toutes les drogues sauf les drogues d’urgence de santé publique).
Les modifications réglementaires proposées suivantes entreraient en vigueur à un moment fixé dans une modification réglementaire future une fois que le ministère aura déterminé que les dispositions propres à la COVID-19 ne sont plus nécessaires :
- modifier la définition de drogue d’urgence de santé publique pour ne plus inclure une drogue nouvelle dont l’usage ou les conditions d’emploi recommandés par le fabricant se rapportent à la COVID-19;
- abroger d’autres dispositions spécifiques à la COVID-19.
Élaboration de la réglementation
Consultation
Consultations antérieures
Les lignes directrices et les politiques existantes, qui constituent la base de cette proposition, ont fait l’objet de consultations avant leur mise en œuvre et sont maintenant de pratique courante. Par exemple, l’approche stratégique de Santé Canada à l’égard des PGR a été établie en fonction des lignes directrices E2E de la Conférence internationale sur l’harmonisation des exigences techniques relatives à l’homologation des produits pharmaceutiques pour usage humain (PDF, disponible en anglais seulement). Ces lignes directrices étaient fondées sur les commentaires reçus de l’industrie pharmaceutique internationale. Avant la mise en œuvre des lignes directrices finales de Santé Canada sur les PGR, qui ont été bien reçues par l’industrie, une importante consultation a été menée pour assurer l’harmonisation avec les lignes directrices internationales qui ont été mises en œuvre par d’autres administrations.
Santé Canada a également entendu les intervenants sur la nécessité d’une souplesse réglementaire au cours du processus pour l’examen de la réglementation du secteur des sciences de la santé et des sciences biologiques de 2018.
De plus, des consultations ont eu lieu avant de prendre les arrêtés d’urgence et les règlements provisoires portant sur la COVID-19. Les résultats de ces consultations sont résumés dans un rapport Ce qui a été entendu affiché en ligne, ainsi que dans les notes explicatives sur les arrêtés d’urgence concernant les instruments médicaux et le résumé de l’étude d’impact de la réglementation accompagnant le règlement qui a transformé l’arrêté d’urgence concernant les médicaments en règlement. Les intervenants n’ont soulevé aucune préoccupation quant à la capacité du ministre d’imposer des conditions sur les drogues contre la COVID-19 et les instruments médicaux destinés à être utilisés à l’égard de la COVID-19. Les intervenants étaient également favorables à l’utilisation d’examens en continu, et un intervenant a suggéré que les examens en continu soient élargis à d’autres drogues d’importance vitale.
Au fil des années, les fabricants ont demandé de faire preuve de souplesse dans les exigences en matière d’étiquetage relatives aux normes pour les drogues. De plus, lorsqu’ils revendiquent la norme d’un fabricant, les fabricants ont indiqué que les exigences actuelles sont trop restrictives en ce qui concerne la pureté et la puissance d’une drogue.
Les intervenants ont exprimé leur appui à la modernisation des exigences relatives aux produits biologiques au fil des ans. Depuis plus de 10 ans, le ministère a effectué des analyses techniques, scientifiques et stratégiques importantes du titre 4 et de l’annexe D. Tout au long de cette analyse, les intervenants de l’industrie ont été consultés et ont appuyé les efforts de modernisation de Santé Canada.
Avis d’intention
Les commentaires des intervenants sur certaines des composantes ont été demandés à la suite de la publication d’un avis d’intention de 90 jours dans la Partie I de la Gazette du Canada. La consultation a eu lieu du 31 juillet 2021 au 28 octobre 2021. Pendant cette période, on a également demandé aux intervenants de l’industrie de remplir un sondage sur les coûts-avantages. Des réunions ont également eu lieu avec des organismes d’évaluation des technologies de la santé (ETS) et des partenaires du système de santé comme les provinces et les territoires. Ces réunions ont servi à donner un aperçu de l’avis d’intention et à répondre aux questions des intervenants au sujet des modifications proposées au RAD et au RIM.
Réponse
Santé Canada a reçu 25 réponses de la part d’entreprises pharmaceutiques et d’instruments médicaux, d’associations de l’industrie, d’organismes d’ETS, de provinces et de territoires, d’associations représentant des professionnels de la santé et des particuliers, ainsi que 32 sondages sur les coûts-avantages réalisés auprès d’intervenants de l’industrie. Les commentaires reçus ont été utilisés pour peaufiner les modifications proposées incluses dans cette proposition.
Les intervenants étaient généralement en faveur des modifications proposées; toutefois, ils ont demandé que des détails supplémentaires concernant la mise en œuvre soient fournis. Ils ont notamment exprimé leur soutien aux efforts de Santé Canada pour accroître la souplesse réglementaire, réduire les irritants connus, améliorer l’accès aux produits thérapeutiques et améliorer la surveillance après la mise en marché tout au long du cycle de vie d’une drogue ou d’un instrument médical.
Conditions — Drogues et instruments médicaux (modifications au RAD et au RIM)
En ce qui concerne les conditions, certains intervenants de l’industrie ont recommandé que les conditions relatives aux drogues et aux instruments médicaux ne soient utilisées que dans des circonstances exceptionnelles. Les organismes d’ETS voulaient mieux comprendre les répercussions des conditions sur leurs processus d’examen. Les répondants ont également indiqué que les conditions devraient être harmonisées à l’échelle internationale afin de réduire le fardeau et, par conséquent, les coûts pour l’industrie, et qu’une possibilité d’être entendu devrait être offerte au fabricant avant que les conditions ne soient appliquées à l’identification numérique d’une drogue. Une association représentant les pharmaciens a indiqué que les conditions des drogues ne devraient pas se traduire par des exigences préalables à la mise en marché moins rigoureuses et qu’il faudrait prendre soin de ne pas avoir d’incidence sur la pratique des professionnels de la santé. Un intervenant du secteur des instruments médicaux a remis en question le besoin de conditions pour les instruments de classe II (c’est-à-dire les instruments à fiable risque). Un intervenant de l’industrie a indiqué qu’il serait judicieux d’harmoniser les exigences des conditions pour les drogues et les instruments médicaux, étant donné qu’il existe des produits de santé à la frontière entre les drogues et les instruments médicaux. Pour répondre à ces préoccupations, les modifications proposées au RAD et au RIM énoncent des considérations dont le ministre devrait tenir compte avant d’imposer des conditions. Les conditions ne seraient pas utilisées comme mécanisme pour remplacer les exigences préalables à la mise en marché.
PGR (modifications au RAD)
Certains intervenants ont exprimé des préoccupations au sujet de fausses déclarations si Santé Canada devait rédiger et traduire des résumés de leurs PGR. En réponse à cette préoccupation, les modifications réglementaires proposées exigeraient que les fabricants incluent des résumés de leurs PGR dans les deux langues officielles au moment du dépôt de la présentation pour examen par Santé Canada.
Les intervenants ont exprimé une volonté de maintenir certaines pratiques opérationnelles existantes, comme la capacité de négocier le contenu des PGR pendant le processus d’examen de présentations de drogues. De plus, les intervenants ont indiqué que les PGR ne devraient pas avoir d’incidence sur la pratique des professionnels de la santé (par exemple les programmes de distribution contrôlée qui auraient une incidence sur la capacité d’un pharmacien à prescrire une drogue).
Les organismes d’ETS ont indiqué qu’ils aimeraient obtenir des détails supplémentaires sur les opérations et la mise en œuvre de la façon dont les PGR seraient examinés par Santé Canada en raison d’une incidence prévue sur leurs processus d’examen.
Examens en continu (modifications au RAD)
Les organismes d’ETS voulaient aussi mieux comprendre comment les examens en continu seraient mis en œuvre et l’effet que ces modifications proposées pourraient avoir sur leur processus d’examen. De plus, les intervenants de l’industrie se sont généralement prononcés en faveur de l’option des examens en continu; toutefois, ils ont demandé des précisions supplémentaires sur les types de drogues qui seraient admissibles à un examen en continu et sur la façon dont ces modifications seraient mises en œuvre. Les intervenants ont également fait part de leurs attentes quant aux avantages d’un examen en continu qui devraient être évidents par rapport aux autres options d’évaluations prioritaires des présentations.
Modernisation des exigences concernant les produits biologiques (modifications au RAD)
En ce qui concerne la modernisation des dispositions relatives aux produits biologiques, les intervenants ont indiqué que l’approche réglementaire finale pour les analyses de mise en circulation de lots devrait être fondée sur les risques et souple. Santé Canada utilise actuellement l’approche échelonnée et fondée sur les risques décrite dans la Ligne directrice à l’intention des promoteurs : Programme d’autorisation de mise en circulation des lots de drogues visées à l’annexe D (produits biologiques). Les modifications réglementaires proposées permettraient l’utilisation continue d’une approche axée sur les risques.
Les intervenants étaient en faveur de la modernisation des exigences en matière d’étiquetage des produits biologiques, mais ils ont suggéré que des considérations d’espacement soient prises pour les petites étiquettes, que l’acceptation d’étiquettes universelles et de codes lisibles par machine soit prise en considération et que tout changement, comme l’exigence proposée d’indiquer l’espèce d’origine, ne devrait pas avoir d’incidence sur la capacité des professionnels de la santé de prescrire certaines drogues. Plusieurs intervenants ont déclaré que si d’autres moyens d’indiquer la date d’expiration des drogues entreposées étaient autorisés, l’exigence devrait faire en sorte que la date soit rapidement et facilement disponible aux professionnels et aux patients qui utilisent la drogue. Les modifications réglementaires proposées pour l’étiquetage des produits biologiques dans de petits contenants offriraient aux fabricants la souplesse déjà offerte au titre 1 pour les autres drogues. À l’heure actuelle, il n’y a aucune restriction à l’utilisation d’étiquettes universelles ou de codes lisibles par machine, pourvu qu’ils respectent les exigences de la législation canadienne. Santé Canada continue d’appuyer la capacité des professionnels de la santé à prescrire des drogues, notamment en veillant à ce que l’information sur une drogue soit claire et accessible.
Bien que les ESP soient une pratique courante, certains intervenants de l’industrie ont indiqué que cela est une exigence propre au Canada et qu’elle représente donc un fardeau supplémentaire. Certains intervenants ont suggéré que Santé Canada élimine cette pratique au profit de l’utilisation d’information provenant d’autres sources, comme les inspections des BPF. D’autres intervenants ont indiqué que les ESP devraient être flexibles et axées sur le risque, ou davantage harmonisées avec les inspections propres aux produits comme celles effectuées par l’EMA ou la FDA. Les inspections des BPF diffèrent des ESP en ce sens que les inspections des BPF ne sont pas propres au produit. Les ESP sont un outil essentiel utilisé par le ministère d’une manière axée sur les risques pour un sous-ensemble de présentations de drogue. Il s’agit d’une activité liée aux présentations, qui consiste à évaluer le processus de fabrication du produit, à valider l’information fournie dans la présentation de drogue et à évaluer le processus de fabrication mis en œuvre au site. Santé Canada applique actuellement une approche fondée sur le risque pour décider si des renseignements supplémentaires obtenus des ESP concernant la mise en œuvre du processus de fabrication dans les installations proposées sont nécessaires pour appuyer la prise de décisions concernant les présentations de drogue nouvelle ou les suppléments à une présentation de drogue nouvelle pour les produits biologiques. L’approche fondée sur le risque tient compte de facteurs comme la complexité ou la nouveauté du processus de fabrication, la connaissance du site par Santé Canada et l’expérience du fabricant dans la production d’une drogue sécuritaire et uniforme. La modification réglementaire proposée assurerait la transparence en ce qui concerne l’inclusion de l’information obtenue directement ou indirectement à partir des sites de fabrication dans le processus décisionnel pour l’autorisation de mise en marché.
Hors de portée
Santé Canada a également reçu un certain nombre de commentaires qui n’entraient pas dans la portée de cette proposition réglementaire. Ceux-ci comprenaient les commentaires sur le processus d’autorisation des essais cliniques, les souplesses liées à l’étiquetage et à l’accès au marché des médicaments génériques, les examens en continu des licences d’établissement de produits pharmaceutiques et des instruments médicaux, et les modifications aux frais d’autorisation des médicaments vétérinaires afin de faciliter l’accès au marché et d’être concurrentiel à l’échelle mondiale.
Obligations relatives aux traités modernes et consultation et mobilisation des Autochtones
Comme l’exige la Directive du Cabinet sur l’approche fédérale pour la mise en œuvre des traités modernes, le projet a fait l’objet d’une évaluation détaillée des répercussions des traités modernes. L’évaluation n’a cerné aucune répercussion sur ou obligation envers les traités modernes.
Choix de l’instrument
Santé Canada a examiné les options réglementaires et non réglementaires suivantes.
Option 1 : Ne pas introduire de modifications réglementaires et maintenir le statu quo
Sans les modifications proposées au RAD et au RIM, le ministère n’atteindrait pas son objectif de fournir un pouvoir réglementaire clair pour les souplesses, dont certaines sont actuellement en place par le biais de politiques, pour suivre le rythme de l’innovation et faciliter l’accès à des traitements de pointe et à des thérapies prometteuses, tout en continuant de s’assurer que les drogues autorisées et les instruments médicaux homologués sont sûrs, efficaces et assujettis à une surveillance appropriée, conformément à son engagement pris dans la Feuille de route du secteur de la santé et des sciences biologiques. L’absence de modifications visant à codifier ces souplesses donne lieu à un manque de certitude pour les fabricants quant au fait que les souplesses seraient disponibles et appliquées de façon uniforme.
De plus, des engagements juridiquement contraignants pour la gestion des risques et des incertitudes au moyen des conditions continueraient de s’appliquer seulement aux opioïdes et aux drogues contre la COVID-19. En vertu du RIM, les pouvoirs des conditions seraient limités aux essais pour les instruments de classe II à IV, tandis que les conditions générales s’appliqueraient uniquement aux instruments médicaux destinés à être utilisés à l’égard de la COVID-19 autorisés en vertu de l’arrêté d’urgence actuel.
L’option de maintenir le statu quo ne garantit pas qu’il existe des fondements juridiques en place pour mettre en œuvre un cadre sur les drogues et les instruments médicaux qui surveille efficacement les drogues et les instruments médicaux réglementés tout au long de leur cycle de vie.
Option 2 : Proposer des modifications réglementaires visant à introduire des éléments de modernisation au cadre réglementaire pour les drogues et les instruments médicaux
Il s’agit de l’option préférée, car elle garantirait que le ministre dispose des outils appropriés pour surveiller l’innocuité et l’efficacité des drogues et des instruments médicaux au moyen de conditions exécutoires. Le Canada passerait d’un cadre juridique où Santé Canada réagit passivement aux problèmes à un cadre où les risques sont atténués de façon proactive au moyen d’exigences réglementaires comme les conditions et les PGR. Elle favoriserait également l’accès rapide des Canadiens aux drogues essentielles en incluant une option pour un examen en continu.
Cette option permettait au ministère de commencer à respecter les engagements pris dans la Feuille de route du secteur de la santé et des sciences biologiques, de réduire le fardeau sur l’industrie et de mettre ses règlements à jour avec la pratique actuelle afin qu’ils soient clairs pour les intervenants.
Analyse de la réglementation
Avantages et coûts
L’analyse coûts-avantages (ACA) vise à quantifier les avantages et les coûts du projet de Règlement modifiant certains règlements pris en application de la Loi sur les aliments et drogues (homologation agile).
Le rapport complet sur l’ACA est disponible sur demande.
Énoncé des coûts et des avantages
Les coûts supplémentaires pour l’industrie sont estimés à 158 millions de dollars (VA) sur une période de 10 ans. Il devrait coûter au gouvernement au cours de la même période 26 millions de dollars (VA) pour examiner et gérer les conditions et les examens en continu. Par conséquent, le coût total prévu du règlement proposé en VA est de 184 millions de dollars sur une période de 10 ans, actualisé à 7 %, ou une moyenne annualisée d’environ 26 millions de dollars.
Les avantages quantifiés comprennent des ventes estimées à 70 millions de dollars en VA provenant de l’obtention d’une autorisation de marché deux mois plus tôt que dans le cadre du statu quo. Les Canadiens devraient bénéficier d’une amélioration de leur qualité de vie grâce à une VA de 302 millions de dollars. De plus, l’élimination des exigences réglementaires relatives aux normes devrait profiter à l’industrie de 68 millions de dollars (VA). L’avantage total prévu se chiffrerait à 440 millions de dollars sur une période de 10 ans, actualisé à 7 %, soit une moyenne annualisée d’environ 63 millions de dollars (VA).
- Nombre d’années : 10 (de 2024 à 2033)
- Année du niveau de prix : 2021
- Année de référence de la VA : 2024
- Taux d’actualisation : 7 %
| Intervenant touché | Description de l’avantage | Année 1 | Année 2 | Année 3 | Dernière année | Total (VA) | Valeur annualisée |
|---|---|---|---|---|---|---|---|
| Industrie | Deux mois de ventes | 0 $ | 10 710 000 $ | 10 710 000 $ | 10 710 000 $ | 69 778 137 $ | 9 934 837 $ |
| Industrie | Normes | 9 112 500 $ | 9 112 500 $ | 9 112 500 $ | 9 112 500 $ | 68 482 554 $ | 9 750 375 $ |
| Canadiens | Deux mois d’AVAQ note a du tableau b1 | 0 $ | 44 720 676 $ | 45 167 883 $ | 48 426 084 $ | 301 944 819 $ | 42 990 149 $ |
| Tous les intervenants | Total des avantages | 9 112 500 $ | 64 543 176 $ | 64 990 383 $ | 68 248 584 $ | 440 205 510 $ | 62 675 361 $ |
Note(s) du tableau b1
|
|||||||
| Intervenant touché | Description du coût | Année 1 | Année 2 | Année 3 | Dernière année | Total (VA) | Valeur annualisée |
|---|---|---|---|---|---|---|---|
| Gouvernement | Conditions | 0 $ | 3 145 964 $ | 3 145 964 $ | 3 145 964 $ | 20 496 684 $ | 2 918 267 $ |
| Gouvernement | Examens en continu | 131 888 $ | 635 895 $ | 635 895 $ | 635 895 $ | 4 274 892 $ | 608 648 $ |
| Gouvernement | Solutions de TI | 1 028 207 $ | 65 887 $ | 65 887 $ | 65 887 $ | $1 457 476 $ | 207 512 $ |
| Industrie | Conditions — Médicaments | 0 $ | 7 293 333 $ | 14 586 667 $ | 21 880 000 $ | 122 550 603 $ | 17 448 449 $ |
| Industrie | Conditions — Instruments médicaux | 0 $ | 1 090 000 $ | 2 180 000 $ | 3 270 000 $ | 18 315 378 $ | 2 607 698 $ |
| Industrie | PGR | 0 $ | 2 289 600 $ | 2 289 600 $ | 2 289 600 $ | 14 917 276 $ | 2 123 884 $ |
| Industrie | Examens en continu | 0 $ | 360 000 $ | 360 000 $ | 360 000 $ | 2 345 484 $ | 333 944 $ |
| Tous les intervenants | Coûts totaux | 1 160 095 $ | 14 880 679 $ | 23 264 012 $ | 31 647 346 $ | 184 357 792 $ | 26 248 402 $ |
| Répercussions | Année 1 | Année 2 | Année 3 | Dernière année | Total (VA) | Valeur annualisée |
|---|---|---|---|---|---|---|
| Total des avantages | 9 112 500 $ | 64 543 176 $ | 64 990 383 $ | 68 248 584 $ | 440 205 510 $ | 62 675 361 $ |
| Coûts totaux | 1 160 095 $ | 14 880 679 $ | 23 264 012 $ | 31 647 346 $ | 184 357 792 $ | 26 248 402 $ |
| IMPACT NET | 7 952 405 $ | 49 662 497 $ | 41 726 370 $ | 36 601 238 $ | 255 847 718 $ | 36 426 959 $ |
En ce qui concerne les avantages qualitatifs, on s’attend à ce que les modifications proposées apportent une clarté à l’industrie et à l’organisme de réglementation, ce qui permettra une plus grande souplesse pour faire face aux innovations futures. De plus, elles contribueraient à l’approche du cycle de vie de la réglementation des produits thérapeutiques nécessaires pour protéger les Canadiens contre les effets nocifs des produits thérapeutiques qu’ils utilisent tout en leur offrant les avantages thérapeutiques. Le résultat d’une approche du cycle de vie devrait être une réduction des effets indésirables et des incidents liés aux matériels médicaux.
Scénario de référence
Le niveau de référence reflète les processus opérationnels et d’examen actuels et sert de base au calcul de tout coût supplémentaire.
Avant d’adopter la Loi de Vanessa (2014), Santé Canada avait des options limitées lorsqu’un problème grave d’innocuité se posait concernant un produit commercialisé. Le ministre avait la capacité d’imposer des conditions touchant les essais pour les homologations d’instruments médicaux, mais cela n’était pas le cas pour les autres produits. Santé Canada pouvait également conserver un produit sur le marché tout en émettant un avertissement de sécurité et en négociant possiblement un changement d’étiquette avec le fabricant. Autrement, le produit aurait été retiré du marché, ce qui pourrait priver les Canadiens de produits commercialisés pouvant sauver des vies. Les pouvoirs sur le cycle de vie instaurés par la Loi de Vanessa au niveau de la Loi ont amélioré les options réglementaires pour maintenir les produits sur le marché tout en améliorant la capacité de Santé Canada à régler les problèmes de sécurité.
Ces pouvoirs ont aidé Santé Canada à adopter une approche de la réglementation axée sur le cycle de vie des produits; toutefois, un certain nombre de politiques de Santé Canada sont encore exercées au moyen de directives.
Conditions
Le ministre a actuellement le pouvoir d’imposer des conditions relatives aux essais sur les homologations d’instruments médicaux de classe II à IV et de modifier les conditions pour tenir compte de tout nouveau développement relatif à l’instrument. À l’heure actuelle, les règlements permettent également au ministre d’imposer des conditions sur l’identification numérique d’une drogue pour les opioïdes et les drogues désignées contre la COVID-19. En vertu de la politique sur les AC-C de Santé Canada, les fabricants acceptent de se conformer aux conditions visant à confirmer l’efficacité des nouvelles drogues pour usage humain avec des preuves cliniques prometteuses pour traiter des affections graves ou mettant en danger la vie. Les conditions de la politique sur les AC-C sont semblables à celles des autres administrations; toutefois, elles reposent sur la conformité volontaire et ne sont pas exécutoires. La politique sur les AC-C n’a pas été appliquée aux médicaments vétérinaires et des conditions n’ont pas été imposées aux identifications numériques d’une drogue des médicaments vétérinaires.
Plans de gestion des risques
À l’heure actuelle, les fabricants se conforment volontairement aux directives sur la soumission des PGR. Habituellement, les PGR sont présentés dans le même format que celui exigé par l’EMA. Santé Canada engage certains coûts liés aux négociations pendant le processus d’examen des présentations pour harmoniser le contenu des PGR avec les recommandations dans les lignes directrices sur le contenu propre au Canada. Étant donné que les PGR ne sont pas une exigence de la réglementation, le ministre a peu de pouvoir pour obliger un fabricant à soumettre un PGR complet en temps opportun, ce qui entraîne un temps de négociation avec le fabricant.
Examens en continu
À l’heure actuelle, le RAD envisage explicitement de procéder à des examens en continu pour les drogues désignées contre la COVID-19. Des examens en continu sont également disponibles pour les médicaments vétérinaires pour lesquels le ministre a indiqué son intention de mener l’examen en collaboration avec un organisme de réglementation étranger et pour les mises à jour annuelles des vaccins contre la grippe saisonnière.
Scénario réglementaire
Les modifications réglementaires sont décrites sous chaque élément proposé ci-dessous.
Coûts pour l’industrie
Conditions pour les drogues
En vertu du règlement proposé, des conditions pourraient être imposées en tout temps, mais il est prévu qu’elles ne seraient pas imposées à chaque drogue autorisée. Elles seraient utilisées pour gérer les incertitudes liées aux avantages et/ou aux risques (par exemple demande d’études cliniques confirmatives, d’études de qualité et/ou d’efficacité).
Conformément aux critères de la politique sur les AC-C, des conditions sont actuellement appliquées aux nouvelles drogues pour usage humain avec des preuves cliniques prometteuses pour traiter des affections graves ou mettant en danger la vie. Les coûts et avantages supplémentaires seraient mesurés en fonction de la pratique actuelle de la politique sur les AC-C.
La politique sur les AC-C ne s’applique pas aux médicaments vétérinaires. Par conséquent, à ce jour, aucune AC-C ni aucune condition n’a été imposée aux médicaments vétérinaires. Toutefois, les modifications réglementaires proposées définissant les conditions permettraient aux fabricants de médicaments vétérinaires d’être assujettis à ce pouvoir.
En moyenne chaque année, Santé Canada émet sept AC-C. En fonction de l’analyse interne et de l’élargissement de la portée de la proposition, on prévoit une augmentation de 10 conditions émises chaque année. Dans le cadre d’une enquête sur l’établissement des coûts envoyé à l’industrie (enquête sur l’ACA) menée entre juillet et octobre 2021, les intervenants ont indiqué un large éventail de coûts des conditions, à la fois en fonction de leur expérience avec les AC-C et les conditions dans d’autres administrations et des coûts prévus. Les coûts déclarés varient de 4 000 $ (présentation des résultats d’une étude) à 6,2 millions de dollars (réalisation d’une étude clinique). D’après les réponses de ceux qui ont eu de l’expérience avec les AC-C et les conditions, les coûts moyens des conditions sont estimés à 2,2 millions de dollars. Ces coûts comprendraient la production de rapports d’études cliniques pour les études en cours, la surveillance et la fourniture de toutes les mises à jour sur les changements dans les maladies et la fourniture de renseignements supplémentaires.
On suppose que des conditions se régleraient d’ici trois ans, comme l’ont indiqué certains intervenants, et que leur coût serait réparti également sur cette période.
Le coût estimé des conditions pour l’industrie au cours de la première année de mise en œuvre (deuxième année du règlement) sont de 7 293 333 $, de 14 586 667 $ pour la deuxième année et de 21 880 000 $ pour chaque année suivante. La VA est d’environ 122 550 603 $ sur une période de 10 ans, actualisée à 7 %.
Conditions pour les instruments médicaux
En vertu du présent RIM, les fabricants sont tenus de se conformer aux conditions qui sont imposées sur les homologations d’instruments médicaux de classe II à IV, et la capacité du ministre d’imposer des conditions est limitée aux exigences d’essai. Le règlement proposé élargirait la portée des conditions au-delà des exigences relatives aux essais, où des conditions peuvent être imposées ou modifiées au moment de l’homologation ou après l’homologation et devraient se rapporter principalement aux incertitudes liées aux avantages et/ou aux risques d’un instrument médical.
On s’attend à ce que les conditions puissent être utilisées pour évaluer l’innocuité ou l’efficacité à long terme d’un instrument médical en réponse à des preuves, y compris des preuves réelles, qui ne sont pas disponibles au moment de la délivrance de l’homologation. Elles pourraient également être utilisées pour recueillir des données spécifiques après l’homologation pour des sous-groupes sous-représentés de données cliniques afin d’améliorer l’étiquetage ou les statistiques des sous-populations spécifiques (par exemple femmes enceintes, pédiatrie).
En moyenne, chaque année, il y a environ 1 810 licences d’instruments médicaux homologués et 150 conditions émises. En vertu du règlement proposé, on prévoit une augmentation de 5 % à 10 % des conditions émises. Par souci de prudence, on suppose que les conditions augmenteraient de 10 % ou que 15 conditions supplémentaires seraient émises par année. De plus, les données historiques ont montré que des conditions sont habituellement réglées à l’intérieur de trois ans. Tout comme pour le traitement des conditions pour les drogues, le coût de conformité aux conditions des instruments médicaux serait réparti sur la période de trois ans.
Selon les réponses au sondage d’établissement des coûts, les coûts de l’exécution des conditions varient de 4 000 $ à 1 million de dollars. Cela est basé sur l’expérience des intervenants à l’égard des conditions y compris, sans s’y limiter, leurs activités allant de la présentation des résultats d’une étude finale, des données non cliniques supplémentaires et/ou des résultats d’une étude en cours à une nouvelle étude clinique pour confirmer l’efficacité. Le coût moyen de l’exécution des conditions est de 218 000 $.
Les coûts prévus des conditions pour les instruments médicaux au cours de la première année de mise en œuvre (deuxième année du règlement) sont de 1 090 000 $, de 2 180 000 $ pour la deuxième année et de 3 270 000 $ pour chaque année suivante. Cela se traduit par une VA de 18 315 378 $ sur une période de 10 ans, actualisée à 7 %.
Plans de gestion des risques
Le règlement proposé officialiserait la pratique de demander des PGR aux fabricants de drogues pour usage humain. Conformément à la pratique actuelle, les fabricants seraient tenus d’inclure des renseignements propres au Canada, selon le contexte et le marché canadien. Le ministre pourrait également exiger un PGR à jour s’il y avait des motifs raisonnables de croire que les risques et les incertitudes associés à la drogue sont considérablement différents du plan existant ou si la drogue présente un risque grave de préjudice à la santé humaine qui justifie des mesures visant à réduire la possibilité ou la gravité d’un tel préjudice qui sont considérablement différentes de celles décrites dans le plan actuel. Les modifications créeraient également une nouvelle obligation pour les fabricants de soumettre un résumé des PGR nouveaux et mis à jour dans les deux langues officielles.
À l’heure actuelle, Santé Canada reçoit en moyenne 103 nouveaux PGR par année, conformément à la ligne directrice. Tous ces nouveaux PGR sont soumis volontairement sur demande. Sur ces 103 PGR, la plupart ont déjà fourni des résumés, mais seulement en anglais; par conséquent, on s’attend à ce que les fabricants doivent traduire ces résumés de PGR. De plus, Santé Canada reçoit en moyenne 321 PGR mis à jour par année. En vertu du règlement proposé, tous les 321 PGR mis à jour exigeraient un résumé dans les deux langues.
En réponse à l’enquête sur l’ACA, les intervenants ont fourni une vaste gamme de coûts allant de l’élaboration d’un PGR de base, à la création d’un résumé, à la traduction. Il est à noter que la plupart des coûts fournis sont fondés sur l’expérience réelle de l’élaboration de PGR au Canada ou dans d’autres pays. Il est reconnu que la traduction d’un résumé mis à jour exigerait beaucoup moins de temps et d’efforts que la préparation du résumé initial, car la plupart des changements apportés à un résumé concernent l’ajout ou la suppression d’un problème d’innocuité ou d’une mesure de réduction des risques. Par conséquent, le coût de la traduction d’un résumé mis à jour devrait également être inférieur. Toutefois, en raison du manque de données et par souci de prudence, Santé Canada utilise le même coût que la traduction d’un nouveau résumé comme approximation de coût de traduction d’un résumé mis à jour.
Il est prévu qu’un total de 424 (103 + 321) résumés seront traduits par année à un coût de 5 400 $ par résumé. Cela équivaut à 2 289 600 $ par année, sans remise. La VA est de 14 917 276 $ sur une période de 10 ans, actualisée à 7 %.
Examens en continu
Les modifications proposées permettraient des examens en continu afin de faciliter l’accès en temps opportun aux drogues pour usage humain et vétérinaire nécessaires pour lutter contre les maladies infectieuses émergentes au Canada, ainsi qu’aux drogues pour le traitement, la prévention ou le diagnostic de maladies ou d’affections graves ou gravement débilitantes.
Les exigences proposées avant la soumission de la présentation de drogue incluent un dossier de demande d’examen en continu, qui comprendrait des renseignements démontrant comment la drogue à laquelle la présentation se rapporterait satisfait aux critères d’admissibilité. Cela est semblable au dossier d’évaluation clinique fourni en vertu de la politique sur l’évaluation prioritaire actuelle. De plus, avant de déposer la présentation, le fabricant serait tenu de fournir au ministre un plan de présentation, qui préciserait comment et quand le fabricant a l’intention de fournir les renseignements manquants. On s’attend à ce que les renseignements manquants soient présentés dans deux à quatre transactions dans le délai énoncé dans l’avis. Les intervenants ont indiqué que le coût estimatif pour élaborer et soumettre un plan de présentation se situerait entre 40 000 $ et 59 000 $. Le coût est variable en raison du fait qu’un plan de présentation est une réplique d’une présentation d’examen en continu à l’échelle mondiale ou est préparé pour le Canada seulement. Le coût moyen d’un plan de présentation est présumé être de 49 500 $. De plus, comme l’ont indiqué les intervenants, le coût associé à la fourniture de renseignements manquants est d’environ 7 500 $ par transaction. On suppose qu’il y aurait cinq examens en continu de drogues pour usage humain par année et que les renseignements manquants seraient fournis en moyenne plus de trois transactions par présentation.
L’examen en continu serait une option pour certaines présentations de drogue, puisque les fabricants peuvent plutôt attendre et déposer une présentation non continue ou se fonder sur des politiques d’examen accéléré comme l’évaluation prioritaire. Ainsi, le coût total supplémentaire estimé pour utiliser l’examen en continu plutôt que d’autres options d’examen pour cinq présentations de drogue par année est de 360 000 $. Le coût prévu en VA est de 2 345 484 $ sur une période de 10 ans, actualisée à 7 %.
Des examens en continu existent déjà en pratique pour les mises à jour annuelles des vaccins contre la grippe saisonnière et pour les médicaments vétérinaires pour lesquels le ministre a indiqué son intention de mener l’examen avec un organisme de réglementation étranger. Les modifications fourniraient un cadre réglementaire pour ces pratiques actuelles. Dans le contexte de Santé Canada, des examens conjoints ou parallèles sont effectués avec des organismes de réglementation internationaux, notamment le Centre de médecine vétérinaire de la FDA des États-Unis, sous la supervision du Conseil de coopération en matière de réglementation.
Il n’est pas prévu qu’il y aurait des coûts supplémentaires pour les examens en continu des mises à jour annuelles des vaccins contre la grippe saisonnière ou pour les médicaments vétérinaires pour lesquels le ministre a indiqué son intention de mener l’examen avec un organisme de réglementation étranger puisque le règlement proposé est conçu pour codifier ce qui a été fait en pratique.
Prépositionnement
Il n’est pas prévu qu’il y aurait des répercussions sur l’industrie, car les modifications proposées continueraient de limiter le prépositionnement aux drogues semblables à celles qui traitent la COVID-19, à savoir les drogues d’urgence de santé publique. La décision du prépositionnement d’une drogue d’urgence de santé publique continuerait d’être régie par l’administratrice en chef de la santé publique du Canada pour les conditions énoncées dans la Liste d’affections qui menacent la santé publique.
Assurer la qualité des drogues pendant la fabrication
Les modifications proposées au titre 2 de la partie C ne devraient pas engager des coûts ou imposer un fardeau supplémentaire à l’industrie. Les modifications appuieraient l’intention des exigences existantes en matière de contrôle de la qualité en clarifiant les interprétations de la conformité aux BPF qui sont énoncées dans les documents d’orientation de Santé Canada Lignes directrices sur les Bonnes pratiques de fabrication des drogues (GUI-0001) et Lignes directrices sur le contrôle environnemental lors de l’entreposage et du transport des médicaments (GUI-0069).
Modernisation des exigences relatives aux produits biologiques
Il n’est pas prévu qu’il y aurait des coûts supplémentaires pour l’industrie, car la modification proposée abrogerait les dispositions désuètes propres aux produits allant de C.04.050 à C.04.683, et d’autres éléments des modifications refléteraient également la pratique actuelle.
Renseignements à l’appui de l’examen des présentations de drogue
Il n’est pas prévu qu’il y aurait des coûts supplémentaires pour l’industrie, car les règlements proposés sont conformes à la pratique actuelle.
Données désagrégées relatives aux essais cliniques pour les présentations de drogue nouvelle pour usage humain et suppléments à une présentation de drogue nouvelle pour usage humain
Il n’est pas prévu qu’il y aurait des coûts supplémentaires pour l’industrie, car les fabricants ne seraient tenus de soumettre des données d’essais cliniques ventilées par sous-groupes de population pour appuyer l’innocuité et l’efficacité de la présentation de drogue nouvelle (ou un supplément) que si les données désagrégées ont déjà été présentées à la FDA des États-Unis ou à l’EMA.
Normes
Le règlement actuel exige que les étiquettes intérieure et extérieure de certaines drogues indiquent si soit une norme réglementaire, une norme mentionnée dans une publication à l’annexe B de la Loi, ou la norme d’un fabricant ont été utilisées pour une drogue. Cette exigence s’applique aux drogues réglementées uniquement en vertu du titre 1 et celles réglementées en vertu du titre 8 de la partie C qui ne sont pas également réglementées en vertu des titres 3 et 4 (c’est-à-dire les produits pharmaceutiques radioactifs et biologiques). Santé Canada propose de supprimer cette exigence en matière d’étiquetage. On ne s’attend pas à ce que cet élément de la proposition entraîne des coûts supplémentaires pour l’industrie. Le retrait de cette exigence en matière d’étiquetage permettrait aux fabricants d’avoir l’espace nécessaire pour fournir des renseignements qui sont plus pertinents pour les fournisseurs de soins de santé et les patients.
À l’heure actuelle, si la norme d’un fabricant est utilisée, le Règlement exige que la drogue respecte le degré maximal de pureté et la variation de puissance la plus petite de toute pharmacopée dans laquelle elle est inscrite à l’annexe B de la Loi. Ce règlement s’applique aux drogues réglementées uniquement en vertu du titre 1 et celles réglementées en vertu du titre 8 (y compris celles qui sont également réglementées en vertu des titres 3 et 4 [c’est-à-dire les produits pharmaceutiques radioactifs et biologiques]). Il est proposé que les drogues réglementées en vertu du titre 8 (autre que celles énumérées à l’annexe C de la Loi) à l’égard duquel la norme d’un fabricant est revendiquée seraient exemptées de ce règlement (par exemple les fabricants seraient autorisés à nuancer les limites de pureté et/ou de puissance au-delà de celles indiquées dans une pharmacopée de l’annexe B qui seraient acceptables pour Santé Canada). On ne s’attend pas à ce que cet élément du projet entraîne des coûts supplémentaires pour l’industrie. On s’attend en plus à ce que cet élément réduise le fardeau réglementaire inutile.
Coûts pour le gouvernement
Conditions pour les drogues et instruments médicaux
Il existe une incertitude quant à la fréquence et le type de conditions que Santé Canada pourrait émettre à l’avenir. Il y a deux facteurs qui pourraient créer une augmentation du nombre de conditions émises. La première est une augmentation du nombre de présentations de drogue dans des domaines où il existe des besoins non satisfaits, comme l’oncologie ou les maladies rares pédiatriques (où la probabilité d’appliquer des conditions est relativement élevée). La deuxième est une augmentation générale de l’utilisation des conditions une fois que les autorisations générales des conditions pour les drogues et les instruments médicaux entrent en vigueur, en particulier lorsque les incertitudes ou les risques n’ont peut-être pas été cernés au moment de l’autorisation. L’ACA constate une augmentation initiale du nombre de conditions émises en raison du règlement proposé, mais on ne s’attend pas à ce qu’il y ait une augmentation supplémentaire au cours de la période d’analyse parce que de nombreux facteurs (comme la faisabilité, des moyens moins contraignants ou l’application des exigences existantes) seraient pris en compte avant d’imposer des conditions.
Le coût pour le gouvernement de la gestion des conditions est très variable et dépend du risque du produit évalué et des exigences stipulées dans les conditions. Le coût de la gestion de ces conditions varie de 119 994 $ à 167 982 $, soit en moyenne 143 988 $, par condition imposée au moment de la délivrance de l’autorisation de mise en marché. Le coût de la gestion des conditions imposées après l’autorisation varie de 159 568 $ à 180 562 $, soit en moyenne 170 064 $ par condition. On prévoit que 10 conditions pour les drogues (5 au moment de l’autorisation et 5 après l’autorisation) seraient gérées annuellement par Santé Canada, ce qui représente un coût annuel de 1 570 266 $ ou 10 230 649 $ VA sur une période de 10 ans, actualisée à 7 %.
On dénombre environ 150 instruments médicaux homologués qui font l’objet de conditions en vertu du RIM et on estime que cela augmenterait de 5 à 10 % par année en raison de la portée élargie des conditions. Si la limite supérieure était utilisée, environ 15 nouvelles conditions seraient émises par année à un coût moyen de 105 046 $, ce qui entraînerait des coûts de gestion d’environ 1 575 698 $ par année ou 10 266 035 $ VA sur une période de 10 ans, actualisée à 7 %.
Des coûts supplémentaires pour le gouvernement peuvent également être engagés lorsque des mesures de vérification de la conformité ou d’application de la loi sont prises relativement aux conditions. Le choix par Santé Canada d’une mesure particulière de conformité et d’application de la loi est informé par une approche fondée sur le risque et dépendrait du type de condition. On s’attend à ce que les mesures d’application de la loi soient rares et réservées pour les cas où il est nécessaire de traiter une violation connue ou soupçonnée de condition.
Le coût total pour le gouvernement de la gestion des conditions pour les drogues et les instruments médicaux devrait être de 3 145 964 $ par année ou de 20 496 684 $ VA sur une période de 10 ans, actualisée à 7 %.
Plans de gestion des risques
Santé Canada reçoit actuellement des PGR volontairement, or le gouvernement négocie souvent avec les demandeurs pour harmoniser le contenu des PGR avec ce qui est décrit dans les lignes directrices, particulièrement en vue de l’inclusion d’un addenda portant sur des renseignements propres au Canada. À l’heure actuelle, les recommandations et les commentaires fournis par Santé Canada sont abordés environ 90 % du temps, 70 % de ces PGR étant « acceptés avec des changements mineurs ». Presque tous les fabricants incluent un résumé avec leur présentation de PGR et environ 40 % incluent un addenda de renseignements propres au Canada.
Des coûts supplémentaires pour le gouvernement peuvent découler d’activités de conformité et d’application de la loi qui seraient nécessaires pour remédier à l’incapacité d’un organisme de présenter un plan mis à jour conformément au règlement proposé, mais on s’attend à ce que ces cas soient rares.
Examens en continu
Les modifications proposées permettraient d’offrir l’option d’un examen en continu pour les présentations de drogue nouvelle et les suppléments à une présentation de drogue nouvelle pour certaines drogues. Bien que les modifications permettraient à un fabricant de fournir des composantes de la présentation dans des transactions séquentielles à mesure que l’information devient disponible après le dépôt de la présentation de drogue, la norme et le seuil de données requis pour obtenir une autorisation seraient les mêmes que pour une présentation examinée sans examen en continu. Même si l’information requise pour un examen en continu était exactement la même que pour une présentation de drogue nouvelle non continue ou un supplément à une présentation de drogue nouvelle non continue, le processus d’examen devrait exiger davantage de ressources pour Santé Canada en raison de l’approche progressive de l’examen.
Chaque nouvelle transaction reçue conformément à l’option d’examen en continu devrait exiger un délai supplémentaire pour :
- les révisions des PGR (une fois adoptées dans les règlements);
- les interactions accrues pendant l’étape préalable à la mise en marché;
- les communications des promoteurs (c’est-à-dire que l’examen de la présentation reprendrait à des moments différents à mesure que l’information est fournie aux fins d’examen);
- l’examen du matériel éducatif;
- les commentaires additionnels sur l’étiquetage;
- le délai d’examen supplémentaire pour approbation à l’étape de l’examen final.
De nouveaux coûts ponctuels découleraient également des révisions nécessaires aux documents de procédures opérationnelles normalisées (PON) pour inclure les mises à jour de la formation, l’élaboration de processus et de matériels de processus et une nouvelle surveillance. Ces coûts sont estimés à 131 888 $ au cours de la première année.
Tous les coûts supplémentaires sont supposés être attribuables à un examen non contigu des renseignements fournis à l’appui de la présentation, ainsi qu’au traitement des renseignements manquants après le dépôt de la présentation.
Bien que le contenu d’une présentation aux fins d’examen en continu soit le même que pour la présentation équivalente sans examen en continu, en raison de la nature périodique de l’examen et de l’uniformité requise dans l’ensemble du processus d’examen (de préférence par la même équipe d’examen), le coût supplémentaire pour chaque présentation est estimé à 127 179 $ pour Santé Canada. En supposant qu’il y ait 5 présentations, le coût total prévu au cours des années subséquentes est de 635 895 $ ou 4 274 892 $ VA sur une période de 10 ans, actualisée à 7 %.
De plus, il y a un coût ponctuel prévu de 1 028 207 $ pour tenir compte d’une mise à jour de l’infrastructure des technologies de l’information (TI). Cette mise à jour serait nécessaire pour traiter les transactions supplémentaires pour les examens en continu, les conditions et les PGR. Ce coût devrait également tenir compte des mises à jour dans docuBridge (un système de gestion des présentations), des changements apportés aux formulaires de demande, de la formation et de la mise en œuvre. Pour chaque année subséquente, il y aurait également un coût de 65 887 $ pour gérer les transactions additionnelles pour les examens en continu, les conditions et les PGR. Cela se traduit à un coût total de 1 457 476 $ VA pour les solutions de TI sur une période de 10 ans, actualisée à 7 %.
Prépositionnement
Les modifications proposées permettraient qu’une drogue soit prépositionnée non seulement en réponse à la pandémie de COVID-19, mais pour d’autres urgences de santé publique qui seraient mentionnées dans la Liste d’affections qui menacent la santé publique. Les modifications proposées ne devraient pas donner lieu à la présentation ou à l’examen de renseignements nouveaux ou supplémentaires et n’auraient pas d’incidence sur les activités actuelles du gouvernement. Les coûts prévus devraient être négligeables.
Assurer la qualité des drogues pendant la fabrication
Aucun changement n’est prévu à la surveillance des drogues par Santé Canada ou à la pratique opérationnelle actuelle en ce qui concerne les inspections des BPF à la suite des modifications proposées. Aucun coût supplémentaire n’est prévu pour le gouvernement.
Modernisation des exigences relatives aux produits biologiques
Les modifications visent à intégrer les pratiques opérationnelles et industrielles dans les règlements. Étant donné que la référence de l’analyse des coûts est une pratique actuelle, on ne prévoit aucun coût supplémentaire pour le gouvernement à la suite de ces modifications.
Renseignements à l’appui de l’examen des présentations de drogue
Aucun coût pour le gouvernement n’a été identifié.
Données désagrégées relatives aux essais cliniques pour les présentations de drogue nouvelle pour usage humain et les suppléments à une présentation de drogue nouvelle pour usage humain
On ne prévoit pas qu’il y aurait une incidence sur le nombre de présentations à la suite de cette modification réglementaire. L’exigence proposée pourrait améliorer la qualité des données soumises, car les examinateurs analysent déjà les données désagrégées fournies volontairement, et ces données continueraient d’être examinées comme c’est le cas actuellement. Il pourrait y avoir une autre étape ajoutée à l’examen de la présentation, mais le travail supplémentaire ne devrait pas être important et serait géré par le personnel existant. Une formation des examinateurs serait requise ainsi que l’élaboration des PON, mais les ressources requises font partie de la mise en œuvre du plan d’action sur l’analyse comparative fondée sur le sexe et le genre plus de la Direction générale des produits de santé et des aliments.
Normes
Aucun coût pour le gouvernement n’a été identifié.
Avantages
Les modifications proposées moderniseraient le libellé dans le RAD et le RIM, apporteraient une clarté à l’industrie et à l’organisme de réglementation, ce qui permettra une plus grande souplesse pour faire face aux innovations futures. Bien qu’il soit reconnu que bon nombre des dispositions proposées dans ces modifications ne font que codifier la pratique existante, la clarté fournie devrait favoriser une plus grande innovation et un accès plus rapide aux produits au Canada et fournir des gains d’efficacité à l’industrie, aux payeurs et aux professionnels de la santé tout en améliorant l’innocuité et l’efficacité, et en permettant de dissiper l’incertitude.
Combinés, ces règlements proposés contribueraient à l’approche du cycle de vie de la réglementation des produits thérapeutiques nécessaire pour aider Santé Canada à trouver un équilibre entre la protection des Canadiens contre les effets nocifs des produits thérapeutiques qu’ils utilisent tout en leur offrant des avantages thérapeutiques.
Avantages pour l’industrie
Conditions pour les drogues
Le coût de mise au point d’une drogue sur le marché est estimé entre 800 millions de dollars et 2,5 milliards de dollars lorsque tous les coûts de recherche et de développement, y compris les échecs des drogues, sont inclus. Le processus prend entre 9 et 15 ans de la découverte à l’approbationréférence 3. Au cours du processus de mise au point des drogues, environ 60 % de toutes les drogues échouent en raison du manque de preuves d’innocuité et d’efficacité. Une fois la drogue sur le marché, son rendement dans des conditions réelles peut être différent de celui d’un milieu clinique. Un problème important d’innocuité ou d’efficacité met non seulement la santé et la sécurité des patients en danger, mais le retrait subséquent d’une drogue du marché pourrait coûter des millions de dollars à l’industrie. Dans certains cas, la drogue pourrait avoir été très bénéfique à un groupe de la population tout en posant un risque pour un autre groupe. Les modifications réglementaires proposées visent à préciser les dispositions existantes, à offrir un accès plus rapide ou plus flexible au marché, à prévenir les pénuries et à aider à gérer les incertitudes et les risques afin de réduire la probabilité de défaillance du produit.
L’application des conditions imposées à une identification numérique d’une drogue, avant ou après l’autorisation, en plus de l’utilisation des PGR, aiderait à cerner plus rapidement les problèmes d’innocuité et d’efficacité, permettant ainsi à Santé Canada d’appliquer les stratégies d’atténuation des risques pour répondre aux signaux de sécurité provenant de conditions réelles afin de réduire les dommages, tout en permettant le maintien d’un produit sur le marché avec des contrôles de sécurité appropriés, au besoin. Ceci permettrait à l’industrie de maintenir un produit sur le marché sans interruption.
Conditions pour les instruments médicaux
Les modifications renforceraient la capacité de Santé Canada à assurer une surveillance, une évaluation et une communication continues que ce soit à l’étape de l’homologation ou après la mise en marché des instruments médicaux. Pour l’industrie, cela pourrait signifier l’identification ainsi que la résolution et l’atténuation rapides des risques qui surviennent tout en permettant aux appareils de rester sur le marché sans interruption.
Plans de gestion des risques
Aucun avantage pour l’industrie n’a été identifié.
Examens en continu
Pour l’examen en continu des drogues comme les vaccins contre la grippe saisonnière, les modifications proposées servent à codifier la pratique existante et ne représentent aucun avantage, puisque l’industrie fonctionne déjà comme si les dispositions étaient en place.
En cas d’un événement majeur semblable à la pandémie de COVID-19, le Règlement fournirait à l’industrie des exigences claires pour un examen en continu afin de traiter une urgence de santé publique ajoutée à une liste, qui serait incorporée par renvoi.
Pour les drogues qui satisfont aux exigences d’admissibilité pour avoir accès à l’option d’examen en continu, un accès plus rapide au marché pouvant aller jusqu’à six mois pourrait être possible comparativement au processus normal. À partir d’un examen des délais d’examen prioritaires de Santé Canada et des types de drogues qui devraient être admissibles à un examen en continu, on estime que ces drogues seraient approuvées en moyenne deux mois plus tôt que dans le cadre des processus actuels. Bien qu’il puisse y avoir des coûts associés au fait d’être sur le marché pendant deux mois supplémentaires, la majorité des coûts impliqués sont censés être supportés pour se rendre sur le marché; par conséquent, la valeur des ventes est utilisée comme mesure de l’avantage. En 2019, avant la pandémie, les ventes des 1 364 drogues brevetées au Canada ont atteint 17,2 milliards de dollars, ce qui donne un revenu annuel moyen de 12,6 millions de dollars par drogue brevetéeréférence 4. La moyenne des 10 principales ventes de drogues au Canada en 2020 dépassait 500 millions de dollars, les ventes les plus élevées dépassant un milliard de dollarsréférence 5.
En supposant que cinq drogues, dont les ventes annuelles moyennes (12 600 000 $) ont été approuvées deux mois plus tôt (17 %), l’option d’examen en continu pourrait offrir un avantage à l’industrie de 10,7 millions de dollars en ventes.
5 drogues × 12 600 000 $ × 17 % = 10 710 000 $
L’avantage quantifiable prévu pour l’industrie est de 10 710 000 $ annuellement ou de 69 788 137 $ VA sur une période de 10 ans.
Assurer la qualité des drogues pendant la fabrication
L’avantage attendu est la clarté du Règlement.
Modernisation des exigences relatives aux produits biologiques
Étant donné que les modifications réglementaires servent à moderniser le Règlement et qu’elles refléteraient la pratique actuelle, l’avantage prévu est une plus grande clarté pour l’industrie.
Renseignements à l’appui de l’examen des présentations de drogue
L’avantage attendu est la clarté de l’intention réglementaire.
Données désagrégées relatives aux essais cliniques pour les présentations de drogue nouvelle pour usage humain et les suppléments à une présentation de drogue nouvelle pour usage humain
Aucun avantage pour l’industrie n’a été identifié.
Normes
Les fabricants n’auraient plus à modifier leur étiquette s’il devenait nécessaire pour eux de changer la norme de leur drogue. Le projet libérerait de l’espace sur l’étiquette, ce qui donnerait aux fabricants la souplesse nécessaire pour fournir d’autres renseignements utiles aux patients et aux professionnels de la santé. En outre, pour les drogues qui revendiquent la norme d’un fabricant, les modifications pourraient réduire le temps que les fabricants doivent consacrer à la surveillance de la pharmacopée et le coût des nouveaux essais de drogues pour respecter les normes les plus strictes.
Bien que l’avantage ne se limite pas uniquement aux fabricants de médicaments génériques, ils seraient plus susceptibles de bénéficier de la modification réglementaire proposée. Les intervenants ont indiqué des économies allant de 120 000 $ à 400 000 $ par année; cela inclurait les coûts d’élimination des étiquettes. De plus, les économies réalisées grâce aux normes du fabricant pourraient varier de 45 000 $ à 650 000 $ par année en ce qui a trait à la surveillance et aux nouveaux essais de drogues. Les économies de coûts administratifs liées à la surveillance des pharmacopées de l’annexe B, à l’évaluation des impacts et à la déclaration à Santé Canada sont estimées à environ 37,5 heures pour chaque pharmacopée et supposent qu’il y a trois publications par année. En adoptant une approche moyenne, les économies annuelles réalisées grâce à l’étiquetage et aux normes du fabricant sont d’environ 260 000 $ et de 347 500 $ respectivement. Étant donné qu’il y a 15 entreprises qui fournissent des produits génériques au Canada, on estime que les économies découlant du règlement proposé pourraient s’élever à 9 112 500 $ par année.
15 entreprises × (260 000 $ + 347 500 $) = 9 112 500 $
On s’attend à ce que la modification proposée permette de réaliser des économies annuelles de 9 112 500 $ ou de 68 482 554 $ VA sur une période de 10 ans. De plus, les intervenants ont également indiqué que le règlement actuel cause parfois des pénuries, puisque les nouvelles normes doivent être respectées. Le règlement proposé réduirait ces perturbations des ventes.
Avantages pour le gouvernement
Conditions pour les drogues
Les modifications codifieraient dans la loi les pratiques existantes en vertu de la politique sur les AC-C et permettraient l’imposition de conditions au moment de la délivrance de l’autorisation de mise en marché et après l’autorisation. Elles pourraient réduire le temps nécessaire pour parvenir à une solution dans les discussions avec un fabricant sur la façon de traiter avec les problèmes potentiels d’innocuité et d’incertitude d’un produit. Les modifications pourraient également permettre à Santé Canada de s’adapter à l’innovation et au changement.
Conditions pour les instruments médicaux
Les modifications codifieraient dans la loi les pratiques existantes en matière de conditions à Santé Canada et élargiraient la portée des conditions pouvant être imposées sur une homologation d’instrument médical. Les modifications pourraient également permettre à Santé Canada de s’adapter à l’innovation et au changement.
Plans de gestion des risques
Santé Canada serait capable d’obliger les fabricants à soumettre et à modifier des PGR pour combler toute lacune en temps opportun lorsqu’ils ne l’auraient pas fait volontairement.
Examens en continu
Au cours des 20 dernières années, le Canada a connu trois perturbations majeures sous la forme de maladies infectieuses : le SRAS en 2003, la H1N1 en 2009 et la COVID-19 en 2020. Les drogues utilisées pour traiter ces types d’éclosions de maladies transmissibles pourraient être approuvées au moyen de l’option d’examen en continuréférence 6,référence 7,référence 8. Les modifications au règlement permettraient probablement l’utilisation de l’option d’examen en continu pour les drogues servant à combattre ces types de pandémies, sans avoir recours à des arrêtés d’urgence.
L’utilisation d’examens en continu pour les vaccins contre la grippe saisonnière est une pratique courante bien établie et aucun avantage supplémentaire n’est identifié.
Modernisation des exigences relatives aux produits biologiques
Des règlements modernes et clairement rédigés peuvent réduire le nombre de demandes de renseignements concernant les dispositions, ce qui permettrait à Santé Canada de gagner du temps et des ressources.
Renseignements à l’appui de l’examen des présentations de drogue
Ces modifications proposées clarifieraient le pouvoir du ministre de tenir compte, dans le cadre d’une présentation, des renseignements obtenus directement ou indirectement d’un bâtiment ou d’un site où une drogue est fabriquée, emballée, étiquetée ou analysée, lorsqu’il prend la décision d’autoriser ou non la drogue.
Données désagrégées relatives aux essais cliniques pour les présentations de drogue nouvelle pour usage humain et les suppléments à une présentation de drogue nouvelle pour usage humain
L’exigence proposée pourrait accroître l’utilité des données soumises, en rendant plus évidente l’identification de toute différence potentielle d’innocuité ou d’efficacité entre les sous-populations.
Normes
Aucun avantage pour le gouvernement n’a été cerné.
Avantages aux Canadiens
Avantages combinés
L’utilisation de conditions pour les drogues et les instruments médicaux et de PGR pour les drogues, ainsi que la réception de données désagrégées, augmenteraient l’innocuité de ces produits thérapeutiques au Canada, et pourraient aider à réduire l’incidence des réactions indésirables à un médicament (RIM) et des incidents liés aux matériels médicaux (IMM), et à gérer les incertitudes quant à l’innocuité et à l’efficacité des médicaments et des instruments dans des conditions réelles. Si ces mesures étaient utilisées conjointement avec un examen en continu, il serait possible que de nouvelles drogues dont on a besoin de toute urgence obtiennent une autorisation de mise sur le marché plus tôt.
Conditions pour les drogues
La possibilité d’imposer des conditions au moment de l’autorisation est actuellement limitée aux drogues désignées contre la COVID-19 et à certains opioïdes. En vertu du règlement proposé, l’utilisation élargie des conditions pour toutes les drogues au moment de l’autorisation, ainsi que durant la phase suivant l’autorisation, devrait améliorer l’innocuité des produits.
Malgré des évaluations rigoureuses, la surveillance de l’innocuité et de l’efficacité dans des conditions réelles permet souvent d’identifier les préjudices et les incertitudes qui n’ont pas été démontrés lors des évaluations cliniques préalables à la mise en marché. En 2019, Santé Canada a reçu plus de 96 000 rapports de RIM à l’échelle nationaleréférence 9 liés aux médicaments et on estime que seulement 10 % de toutes les RIM sont signalésréférence 10. Selon les estimations, jusqu’à 1 Canadien sur 1 000 de moins de 65 ans ira à l’hôpital en raison d’une RIM au cours de leur vie. Le nombre passe à 1 sur 200 pour les Canadiens de plus de 65 ansréférence 11. Sur plus de 96 000 signalés à Santé Canada, 18 852 signalements ont mentionné une hospitalisation et peuvent contribuer jusqu’à 6 119 décèsréférence 9. Les femmes sont également plus susceptibles que les hommes de subir une RIMréférence 12. Les médicaments pédiatriques ont rarement les mêmes informations que les médicaments pour adultes, compte tenu des limites éthiques évidentes des tests de produits sur les enfants. D’autres populations qui sont généralement sous-représentées dans les essais cliniques menés dans le cadre de la préparation d’une présentation de drogue réglementaire sont également susceptibles de voir des avantages.
Le coût médical direct des RIM a été calculé comme étant aussi élevé que 20 milliards de dollars (dollars de 2019) par annéeréférence 13. D’après les données déclarées à Santé Canada en 2019, 19,5 % des RIM étaient liés à l’hospitalisation et 2,6 % déclaraient une affection potentiellement mortelleréférence 14. Bien qu’il ne soit pas possible de déterminer dans quelle mesure les modifications réglementaires proposées réduiront la fréquence des RIM au Canada, l’incidence potentielle pourrait être importante. Par exemple, même une diminution de 0,1 % des RIM réduirait le nombre de décès de 6 (6 119 × 0,1 %), ce qui, lorsqu’on l’applique à la valeur de 8,59 millions de dollars d’une vie statistique utilisée au Canadaréférence 15, représenterait un avantage de 50 millions de dollars. De même, une diminution de 0,1 % du coût médical annuel direct estimé à 20 milliards de dollars représenterait une économie de 20 millions de dollars par année. Toutefois, il n’est pas possible d’estimer la réduction des RIM qui pourrait résulter de ce règlement.
En plus du coût direct d’une RIM pour le système de soins de santé ou pour une personne, les membres de la famille et les autres aidants familiaux doivent prendre un congé pour prendre soin d’une personne âgée, d’un enfant ou d’autres personnes qui ont été hospitalisées ou qui sont atteintes d’une déficience. Une réduction du nombre de RIM résultant d’une meilleure surveillance du cycle de vie réduirait les difficultés liées à la nécessité de prendre soin d’une personne. Les RIM provoquent également de l’absentéisme et du présentéisme (travailler lorsqu’on est malade avec une productivité réduite) au travail, ce qui a une incidence sur l’activité économique.
Conditions pour les instruments médicaux
L’élargissement des conditions permettrait de régler les incertitudes et les risques qui ne deviennent apparents que si un instrument médical est utilisé dans de conditions réelles. Cela pourrait être utile pour identifier les populations de patients qui bénéficieraient le plus de l’atténuation des risques graves pour la santé. L’imposition de conditions pourrait réduire les IMM et pourrait empêcher le retrait d’un produit du marché qui aurait pu être utilisé de façon sécuritaire avec les stratégies d’atténuation des risques appropriées.
Plans de gestion des risques
Aucun avantage pour les Canadiens n’a été identifié.
Examens en continu
On s’attend à ce que les Canadiens bénéficient d’examens en continu pour l’approbation de drogues pour usage humain et vétérinaire admissibles. Dans le cadre du statu quo, tous les renseignements requis pour que le ministre puisse évaluer l’innocuité et l’efficacité d’une nouvelle drogue sont disponibles pour un examen au moment de la présentation. La modification réglementaire pourrait permettre à des drogues et à des vaccins spécifiques d’arriver à la conclusion du processus d’examen de Santé Canada jusqu’à six mois plus tôt, car l’examen commencera avant que l’ensemble complet des données soit disponible (la durée dépend du fait qu’il soit mesuré en fonction d’un examen standard ou d’un examen prioritaire). Cela permettra une autorisation plus précoce, ce qui pourrait mener à un accès plus rapide. Cela a le potentiel d’apporter des avantages importants en réduisant les coûts des soins de santé et en améliorant la qualité de vie dans l’ensemble de la population.
Santé Canada, d’après son expérience de l’examen prioritaire, estime que la création d’une nouvelle méthode d’examen en continu mènera à l’octroi d’une autorisation de mise en marché de cinq médicaments par année deux mois plus tôt. Selon le nombre de patients et le type de maladie, les avantages varieront considérablement. Pour évaluer les avantages d’un accès plus rapide, il faut formuler des hypothèses sur la taille du bassin de patients prescrits, et sur l’incidence que la drogue prescrite aura sur la qualité de vie de ceux qui le prennent. Par souci de prudence dans son estimation, Santé Canada suppose que les drogues ciblent de petites populations de patients, comme celles qui se trouvent dans les médicaments pour les maladies rares. Les populations de patients pourraient en fait être beaucoup plus nombreuses dans le cas de drogues oncologiques ou de vaccins utilisant l’option d’examen en continu.
Une maladie rare est définie comme une maladie qui ne touche pas plus de 5 Canadiens sur 10 000, ou un maximum de 17 750 patients. On estime que 1 Canadien sur 12 (2,7 millions) est touché par une maladie rare et qu’il y a plus de 7 000 maladies rares dans le monde. Cela crée une taille moyenne de population de patients de 385 personnes, ce qui est, selon nous, la taille moyenne minimale de population pour toutes les drogues approuvées par cette option. Les drogues en général ne sont efficaces que dans 60 % de la population; c’est pourquoi le nombre de patients bénéficiant d’une drogue peut être réduit à 231. Étant donné que l’option d’examen est destinée à tous les types de drogues qui satisfont aux exigences, on suppose que cela crée un seuil inférieur pour le nombre de patients traités.
2 700 000 personnes ÷ 7 000 maladies rares = 385 patients × 60 % = 231 patients traités
La population du Canada entre 2015 et 2020 avait un taux de croissance moyen de 1 %. Par conséquent, le nombre de patients traités devrait également augmenter de 1 % par année. Donc, d’ici la 10e année d’analyse, la taille des patients traités devrait atteindre 250.
Au Canada, la valeur d’une vie statistique (VVS) utilisée dans l’analyse économique est actuellement fixée par le Conseil du Trésor à 6,4 millions de dollars en dollars de 2007. En tenant compte de l’inflation, la VVS en dollars de 2021 serait de 8,59 millions de dollars. En utilisant l’espérance de vie moyenne au Canada (82 ans)référence 16, l’âge moyen d’un Canadien (41 ans)référence 17, et un taux d’actualisation de 7 %, cela donne une valeur d’une année de vie statistique (VAVS) de 599 370 $ en dollars de 2021 pour le Canadien moyenréférence 18 en utilisant la formule suivante :
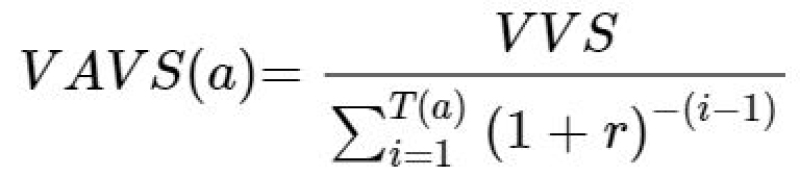
Figure Formule pour calculer la valeur de l'année de vie statistique - Version textuelle
La VAVS à a est égale au quotient de la VVS sur la somme de, parenthèse ouvrante 1 plus r parenthèse fermante, exposant négatif parenthèse ouvrante i moins 1 parenthèse fermante, indexée de 1 à T parenthèse ouvrante a parenthèse fermante.
où VAVS est la valeur d’une année de vie, VVS est la valeur d’une vie statistique, r est le taux d’actualisation, a est l’âge et i est le nombre d’années restantes selon l’espérance de vie à partir de l’âge a.
On suppose que le règlement proposé permettra un accès rapide d’au moins 2 mois (0,17 année). Bien que cela puisse sauver des vies dans certains cas (comme la vaccination contre la COVID-19), il est plus probable que cet accès améliorera la qualité de vie des patients qui reçoivent un traitement. L’année de vie ajustée en fonction de la qualité (AVAQ) est un concept utilisé en économie de la santé pour tenir compte du fait que toutes les années de vie vécues peuvent ne pas être égales en raison de l’expérience de la maladie tout au long de la durée de vie. L’AVAQ de la pleine santé est définie comme étant égale à 1, et la mort comme étant égale à 0. Les valeurs pour d’autres états de maladie ont été calculées entre ces deux extrémités. À tout moment de la vie, la valeur d’une année de vie pour un individu en bonne santé est égale à la VAVS à ce moment-là. Diverses études mesurant l’AVAQ des patients souffrant de diverses maladies et affections ont généré un large éventail de données. Par exemple, l’AVAQ pour le VIH multirésistant a été calculée comme étant 59 % de celle d’une personne en santé. Au moyen d’une enquête, les patients atteints de maladies rares traitables et leurs aidants familiaux ont déclaré avoir une AVAQ de 56 % aux États-Unis et de 50 % au Royaume-Uni, alors que leur estimation était de 42 % aux États-Unis et de 40 % au Royaume-Uni si la maladie était non traitableréférence 19. Une récente étude a examiné 494 nouvelles entités moléculaires approuvées par la FDA entre 1999 et 2015 et a constaté que l’augmentation moyenne de l’AVAQ des patients était de 0,38référence 20. Une amélioration de 0,38 de l’AVAQ pour un Canadien d’âge moyen censé vivre jusqu’à 82 ans représenterait un gain de VAVS de 227 760 $.
599 370 $ VAVS × 0,38 AVAQ = 227 760 $ VAVSadj
Par conséquent, en supposant qu’en moyenne 5 médicaments sont approuvés chaque année, traitant avec succès 231 patients au cours de la première année pendant 2 mois supplémentaires (0,17 an) avec une AVAQ augmentée à 0,38, l’avantage de la première année serait d’environ 44,7 millions de dollars. En supposant une croissance démographique, la valeur atteindrait 48,4 millions de dollars d’ici l’année 10.
Année 2 : 5 drogues × 231 patients × 0,17 année × 227 760 $ VAVSadj = 44 720 676 $
Année 10 : 5 drogues × 250 patients × 0,17 année × 227 760 $ VAVSadj = 48 426 084 $
La VA totale de l’avantage sur 10 ans serait de 301 944 819 $.
Ce nombre ne comprend pas les économies financières pour les familles et les autres aidants qui consacrent du temps et des ressources à soigner les Canadiens atteints de maladies en leur apportant le soutien à la vie quotidienne (par exemple soins personnels, préparation de repas, nettoyage, transport, etc.) dont ils ont besoin.
Prépositionnement
On s’attend à ce que les Canadiens bénéficient des modifications proposées. Dans le cas d’une urgence future en santé publique, le prépositionnement devrait offrir un accès rapide à des drogues propres à l’urgence. En modifiant le règlement afin d’exiger qu’un importateur autorisé soit identifié pour importer la drogue, les risques pour la santé et l’innocuité seraient atténués par l’application d’exigences réglementaires appropriées pour appuyer la surveillance de l’activité d’importation.
Modernisation des exigences relatives aux produits biologiques
Aucun avantage aux Canadiens n’est attendu, car l’innovation se poursuivra comme elle existe actuellement selon l’orientation et la pratique actuelle.
Renseignements à l’appui de l’examen des présentations de drogue
Aucun avantage aux Canadiens n’est attendu, car la modification proposée reflète la pratique actuelle.
Données désagrégées relatives aux essais cliniques pour les présentations de drogue nouvelle pour usage humain et les suppléments à une présentation de drogue nouvelle pour usage humain
Bien qu’aucun avantage direct pour les Canadiens ne soit attendu en raison du projet de règlement, l’exigence de fournir des données désagrégées pourrait fournir des informations supplémentaires concernant des sous-populations spécifiques qui pourraient mener à une innocuité accrue des drogues.
Normes
L’industrie a indiqué que l’exigence actuelle entraîne à l’occasion des pénuries de médicaments. Les Canadiens bénéficieraient d’un approvisionnement en drogues plus stable.
Lentille des petites entreprises
La lentille des petites entreprises s’appliquerait, car tous les intervenants des industries pharmaceutiques, des instruments médicaux et des produits vétérinaires seraient touchés par le règlement proposé.
À l’aide de données internes, Santé Canada a estimé qu’environ 26 % de tous les demandeurs ou fabricants touchés répondraient à la définition de petites entreprises au Canada. La plus grande proportion de petites entreprises dans leur catégorie de produits est celle des instruments médicaux (36 %) et des médicaments vétérinaires (27 %).
Bien qu’il n’y aurait pas d’exemptions ou de processus particuliers proposés dans le nouveau règlement pour les petites entreprises, en dehors de ce qui existe déjà dans la réglementation et dans la pratique, les besoins des petites entreprises ont été pris en considération lors de la création du règlement. Les petites entreprises bénéficieraient également des flexibilités et de la clarté accrues fournies par la modification proposée. Par exemple, les petites entreprises pharmaceutiques pourraient bénéficier de la flexibilité offerte par l’autorisation précoce des drogues dans le cadre de l’option d’un examen en continu, ou attribuer leurs ressources plus efficacement, car les modifications proposées apporteraient plus de clarté. En général, de nombreuses dispositions prendraient en considération les coûts de conformité et d’administration éventuels et/ou les conséquences d’événements indésirables avant d’imposer des conditions ou un PGR à un demandeur ou à un fabricant.
- Nombre de petites entreprises touchées : 225
- Nombre d’années : 10 (de 2024 à 2033)
- Année de référence pour l’établissement des coûts : 2021
- Année de référence de la VA : 2024
- Taux d’actualisation : 7 %
| Activité | Valeur annualisée | Valeur actualisée |
|---|---|---|
| Conditions | 4 471 413 $ | 31 405 337 $ |
| PGR | 169 330 $ | 1 189 304 $ |
| Examens en continu | 11 030 $ | 77 470 $ |
| Coût total de la conformité | 4 651 774 $ | 32 672 112 $ |
| Coût par petite entreprise touchée | 20 675 $ | 145 209 $ |
Règle du « un pour un »
La règle du « un pour un » s’applique puisqu’il y aurait une diminution progressive du fardeau administratif pour les entreprises et le projet serait considéré comme une réduction du fardeau administratif en vertu de la règle. La modification proposée aux exigences relatives aux normes permettrait aux fabricants de drogues d’économiser le temps consacré à la surveillance des pharmacopées de l’annexe B et à l’évaluation des répercussions. Les ressources requises par les entreprises pour surveiller, évaluer les impacts et informer Santé Canada lorsque les normes ont changé seraient considérées comme un fardeau administratif. Ces activités exigent des fabricants qu’ils consacrent en moyenne 37,5 heures à chaque publication de pharmacopée au tarif de 31 $ de l’heureréférence 21, et on suppose qu’il y a trois publications par année. La réduction annuelle du fardeau administratif prévu pour les entreprises est estimée à 25 177 $ (dollars de 2012) ou à 1 678 $ (dollars de 2012) par entreprise.
L’imposition de conditions aurait pour objectif de gérer les incertitudes relatives aux avantages et/ou risques d’un produit au moment de l’autorisation ou de gérer les risques ou incertitudes émergents après l’autorisation. Cette exigence serait directement liée à la protection de la santé et de la sécurité des Canadiens. Par conséquent, les coûts liés au respect des conditions ne sont pas considérés comme un fardeau administratif tel qu’il est défini par la Loi sur la réduction de la paperasse, car leur objectif principal n’est pas d’assurer la conformité.
Actuellement, les fabricants soumettent volontairement des PGR sur demande ainsi que des résumés de PGR s’ils sont disponibles. Ainsi, on ne s’attend pas à ce que le projet de règlement engendre des exigences administratives supplémentaires en ce qui concerne les PGR.
Coopération et harmonisation en matière de réglementation
Bien que ces modifications réglementaires proposées ne fassent pas partie d’un plan officiel de coopération réglementaire avec un organisme de réglementation étranger, elles harmoniseraient davantage les exigences de Santé Canada avec celles d’autres administrations comme les États-Unis, l’Union européenne et l’Australie.
États-Unis
La FDA des États-Unis a la capacité d’obliger, par la loi, un titulaire d’autorisation à mener des activités sur mesure pour gérer les risques et assurer les avantages de ses drogues une fois sur le marché, comme les modifications proposées qui permettraient au ministre d’imposer des conditions sur toute drogue.
La FDA des États-Unis a la capacité d’imposer des exigences post-approbation à certaines classes d’instruments médicaux. Ces conditions peuvent être liées à des restrictions de vente, à des rapports périodiques, à des exigences d’étiquetage ou à des essais, semblables aux modifications proposées concernant les conditions.
Dans le cas de certaines drogues, la FDA des États-Unis peut obliger, par la loi, la présentation d’un plan décrivant les stratégies d’évaluation et d’atténuation des risques [« Risk Evaluation and Mitigation Strategies (REMS) » (disponible en anglais seulement)] du fabricant. Les REMS sont semblables aux PGR; par conséquent, ces modifications proposées au RAD permettraient de mieux harmoniser les exigences canadiennes en matière de stratégies d’atténuation des risques avec celles de la FDA des États-Unis.
La FDA des États-Unis permet l’utilisation d’examens en continu pour certaines drogues à condition qu’elles répondent aux critères décrits dans ses programmes de procédure accélérée, de thérapie innovatrice, d’approbation accélérée, or d’examen prioritaire [« Fast Track, Breakthrough Therapy, Accelerated Approval, Priority Review » (disponible en anglais seulement)]. Les critères d’inclusion comprennent une drogue qui pourrait être utilisée pour répondre à une urgence de santé publique, ou une drogue ayant des preuves cliniques préliminaires indiquant qu’il peut s’agir d’une amélioration importante par rapport aux thérapies existantes pour des maladies graves. Les fabricants qui déposent des demandes d’examen en continu auprès de la FDA des États-Unis ont des interactions plus fréquentes avant la mise en marché avec l’organisme de réglementation et bénéficient d’un accès plus rapide au marché, ce qui serait le cas pour les fabricants qui sont admissibles à des examens en continu avec Santé Canada en vertu des modifications proposées au RAD.
Avant l’autorisation d’une présentation de drogue nouvelle pour certaines drogues composées de petites molécules, pharmaceutiques et biologiques, la FDA des États-Unis évalue les établissements au moyen d’inspections sur place préalables à l’autorisation et/ou d’examens des dossiers d’établissement. Ces inspections sont menées par des inspecteurs, des enquêteurs et d’autres spécialistes des produits d’une manière axée sur les risques, en tenant compte des risques liés aux installations, aux produits et aux processus. L’inspection est effectuée pour contribuer à l’assurance de la FDA des États-Unis qu’un établissement de fabrication nommé dans une présentation de drogue est prêt et capable de fabriquer une drogue, et que les données soumises sont complètes, exactes et conformes à celles du site de fabrication. Cela est analogue à la pratique de Santé Canada de mener des ESP et à la modification proposée qui permettrait de recueillir les documents ou les renseignements à l’appui de l’évaluation d’une présentation de drogue nouvelle.
La FDA des États-Unis exige des fabricants qu’ils présentent des données sur l’innocuité et l’efficacité par certaines sous-populations (par exemple par âge, par sexe, par race ou origine ethnique) et, dans le cas de l’efficacité des données, les fabricants doivent indiquer toute modification à la posologie nécessaire pour ces sous-populations précises.
La FDA des États-Unis exige qu’une drogue soit conforme à la norme de la « United States Phamacopeia/National Formulary (USP/NF) » si la drogue figure dans cette pharmacopée, à moins que certaines conditions ne soient remplies. Elle n’exige pas qu’une liste de pharmacopées soit surveillée. Grâce à ces modifications proposées, les fabricants qui revendiquent une norme d’un fabricant pour leur drogue autorisée au Canada n’auraient plus besoin de surveiller une liste de pharmacopées et de mettre à jour leur produit, au besoin. La FDA des États-Unis n’exige pas qu’un fabricant inclue la norme d’une drogue sur son étiquette. Les modifications proposées seraient conformes à cette pratique.
Union européenne
L’EMA de l’Union européenne a la capacité d’obliger, par la loi, un titulaire d’autorisation à mener des activités sur mesure pour gérer les risques et assurer les avantages de ses drogues une fois sur le marché, comme les modifications proposées qui permettraient au ministre d’imposer des conditions sur toutes les drogues. L’EMA peut également imposer des conditions sur les instruments médicaux dans des cas exceptionnels liés à la santé publique ou à la sécurité des patients.
Comme il est indiqué dans leur ligne directrice sur les PGR (disponible en anglais seulement), l’EMA exige des fabricants qu’ils soumettent des PGR lorsqu’ils demandent une autorisation de mise sur le marché qui sont proportionnels aux risques cernés et aux risques potentiels du produit médicinal, ainsi qu’à la nécessité de disposer de données de sécurité après l’autorisation. L’EMA publie également des résumés de PGR pour les drogues autorisées centralement. Les modifications proposées au RAD permettraient, par conséquent, de mieux harmoniser les exigences canadiennes en matière de stratégies d’atténuation des risques avec celles de l’EMA en permettant que le PGR et les résumés soient présentés dans le format de l’EMA.
L’EMA permet de déposer des présentations aux fins d’examen en continu dans des situations d’urgence comme la pandémie de COVID-19.
L’EMA exige que les fabricants présentent des renseignements sur les populations de sujets d’étude désagrégés selon l’âge et le sexe et qu’ils fournissent une justification lorsque ces données ne sont pas disponibles.
L’EMA exige qu’une drogue soit conforme aux normes européennes en matière de pharmacopée lorsqu’il en existe une. Elle n’exige pas qu’une liste de pharmacopées soit surveillée. Grâce aux modifications proposées, les fabricants qui revendiquent une norme d’un fabricant pour leur drogue autorisée au Canada n’auraient plus besoin de surveiller une liste de pharmacopées et de mettre à jour leur produit, au besoin.
L’EMA n’exige pas qu’un fabricant inclue la norme d’une drogue sur son étiquette. Les modifications proposées seraient conformes à cette pratique.
Royaume-Uni
La Medicines and Healthcare products Regulatory Agency (MHRA) du Royaume-Uni a la capacité d’obliger, par la loi, un titulaire d’autorisation à mener des activités sur mesure pour gérer les risques et assurer les avantages de ses drogues une fois sur le marché, comme les modifications proposées qui permettraient au ministre d’imposer des conditions sur toutes les drogues.
La MHRA exige que les promoteurs soumettent des PGR, des résumés et des mises à jour de PGR pour les nouvelles drogues. Elle continue d’accepter les versions de l’Union européenne d’un PGR, mais peut également exiger une annexe comprenant du contenu national.
La MHRA a publié ses lignes directrices sur les présentations d’examens en continu (disponible en anglais seulement) en décembre 2020 dans le cadre de sa politique Brexit visant à simplifier l’élaboration de nouvelles drogues, y compris les nouvelles substances actives ainsi que les biosimilaires.
Australie
La Therapeutic Goods Administration (TGA) de l’Australie a la capacité d’imposer des conditions au moment de la délivrance d’un certificat d’évaluation de la conformité pour un instrument médical, ou après la délivrance du certificat, semblable aux modifications proposées qui permettraient au ministre d’imposer des conditions sur l’homologation d’instruments médicaux.
La TGA exige des PGR, des résumés et des mises à jour pour des produits spécifiés (à risque plus élevé). Elle continue d’accepter les versions de l’Union européenne d’un PGR, mais peut également exiger une annexe comprenant du contenu national.
La TGA exige que, lorsqu’une norme est disponible pour une drogue dans l’une des pharmacopées par défaut décrites dans leur législation, une drogue doit au minimum satisfaire à ces normes. Les exceptions sont examinées au cas par cas. Avec la modification proposée au RAD, les normes du fabricant qui diffèrent de celles des pharmacopées énumérées à l’annexe B seraient permises, si elles étaient acceptables par le ministre. Les limites devraient être nuancées par des renseignements scientifiques aux fins d’examen par le ministre dans le cadre d’une présentation de drogue.
La TGA n’exige pas qu’un fabricant inclue la norme d’une drogue sur son étiquette. Les modifications proposées seraient conformes à cette pratique.
Harmonisation avec d’autres programmes internationaux
Les modifications apportées au RIM harmonisent les exigences canadiennes avec les lignes directrices décrites par le Forum international des organismes de réglementation des matériels médicaux (IMDRF) en continuant de mettre l’accent sur l’innocuité et l’efficacité de l’instrument.
Santé Canada est membre de l’International Council for Harmonisation. Le Conseil a élaboré une ligne directrice (E2E) décrivant les éléments fondamentaux des PGR que le Canada a adoptée en 2009. Par la suite, le Canada a publié la ligne directrice nationale connexe en 2015. À part les opioïdes, le système canadien ne repose actuellement que sur la ligne directrice, tandis que d’autres administrations importantes (par exemple l’Europe, l’Australie) ont des règlements en place.
D’autres pays comme l’Australie, Singapour, la Suisse et le Royaume-Uni permettent le dépôt de présentations en vue d’un examen en continu dans des situations d’urgence.
Santé Canada a utilisé des examens en continu pour permettre des examens conjoints de médicaments vétérinaires avec la FDA des États-Unis dans le cadre du Conseil de coopération en matière de réglementation. Les modifications réglementaires proposées codifieraient cette pratique.
En ce qui a trait à l’approche pour les produits biologiques, le Canada est semblable à d’autres administrations (les États-Unis, l’Union européenne) et à l’Organisation mondiale de la santé en ce sens qu’il a des règles propres aux produits. Les règles propres aux produits du Canada sont trop prescriptives et désuètes. Les modifications réglementaires proposées offriraient la souplesse nécessaire pour suivre le rythme de l’évolution des sciences et de la technologie au fil du temps grâce à des règlements axés sur les résultats. Santé Canada continuerait de se fier aux lignes directrices internationales, comme celles établies par le Conseil.
Évaluation environnementale stratégique
Conformément à la Directive du Cabinet sur l’évaluation environnementale des projets de politiques, de plans et de programmes, une analyse préliminaire a été effectuée qui a permis de conclure qu’il n’y a pas d’effets environnementaux importants prévus, positifs ou négatifs; par conséquent, une analyse détaillée n’est pas justifiée.
Analyse comparative entre les sexes plus
Santé Canada s’attend à ce que ce projet ait une incidence positive sur toutes les personnes au Canada. Dans certains cas, la sous-représentation dans les essais cliniques et la non-disponibilité des données dans l’espace post-commercialisation pourraient faire en sorte que des sous-populations précises soient confrontées à des risques disproportionnés lorsqu’elles utilisent des instruments médicaux et des drogues en particulier. Selon les drogues et les instruments médicaux qui sont autorisés et la façon dont les modifications réglementaires proposées sont mises en œuvre, il est possible que certaines personnes au Canada en retirent un plus grand avantage et qu’il soit possible de surmonter certains obstacles auxquels sont confrontées les populations à la recherche d’équité et les populations détentrices de droits (par exemple les femmes et les personnes de diverses identités de genre, les minorités raciales et ethniques, les personnes handicapées, les Premières Nations, les Inuits et les Métis, etc.).
Conditions pour les instruments médicaux
Le nombre de personnes handicapées augmente considérablement en raison d’une population vieillissante et de l’augmentation des conditions de santé chroniqueréférence 22,référence 23. Étant donné que l’utilisation d’instruments médicaux chez les personnes handicapées est disproportionnellement élevée comparativement à la population canadienne en généralréférence 24, on s’attend à ce que les personnes handicapées bénéficient de façon disproportionnée de la modification proposée aux conditions des instruments médicaux. Reconnaissant l’intersectionnalité, l’invalidité peut être plus répandue dans certaines sous-populations, avec une prévalence plus élevée apparaissant chez les personnes âgées, chez les femmesréférence 25 et en particulier chez les femmes autochtonesréférence 26,référence 27.
De plus, la race, le sexe et l’âge peuvent, dans certains cas, influencer l’innocuité ou l’efficacité d’un instrument médical. Parfois, certains sous-groupes de la population sont sous-représentés dans la conception d’un instrument médical et dans les études cliniques ou les essais expérimentaux qui y sont associés, ce qui pourrait présenter des difficultés à cerner toute différence dans l’innocuité ou l’efficacité d’un instrument médical dans ces populations. Par exemple, certaines publications récentes ont indiqué que les sphygmo-oxymètres peuvent donner des lectures biaisées des niveaux d’oxygène du sang sur la peau plus sombre. Les patients noirs étaient 29 % moins susceptibles que les patients blancs de voir leur besoin de traitement reconnu par le lecteur d’oxygèneréférence 28.
Les modifications proposées aux conditions régissant les instruments médicaux devraient faire augmenter les niveaux de confiance envers les instruments médicaux utilisés par les diverses populations au Canada.
Données désagrégées, conditions et PGR pour les drogues
Fournir aux organismes de réglementation des données cliniques désagrégées par sous-groupes de population est une étape nécessaire pour déterminer les différences potentielles dans l’efficacité et l’innocuité d’une drogue au sein de diverses populations. Il est de plus en plus évident que l’innocuité et l’efficacité de certains produits de santé sont touchées par un certain nombre de variables, y compris, entre autres facteurs, le sexe, l’âge et la race. Par exemple, certaines drogues sont métabolisées à différents degrés par les populations masculine et féminine (par exemple Ambienréférence 29) et par différents groupes raciaux partageant des traits génétiques spécifiques (par exemple le clopidogrelréférence 30, la warfarineréférence 31). Cela peut entraîner des risques accrus pour ces sous-groupes de population précis, contribuant ainsi aux inégalités en matière de santé dans le secteur des soins de santé.
De plus, certaines populations de sous-groupes demeurent sous-représentées dans les essais cliniques, comme les femmes enceintes, les personnes vivant dans les communautés rurales, et les personnes âgées, ce qui rend difficile l’identification des principales différences en matière d’innocuité ou d’efficacité des drogues au sein de celles-ci.
La réception de données ventilées par sous-groupes de population (par exemple âge, sexe, race) permettrait à Santé Canada d’évaluer l’innocuité et l’efficacité de la nouvelle drogue contre ces populations sous-représentées, le cas échéant. Les modifications proposées permettraient également au Ministère d’exiger l’analyse, dans les spécifications d’innocuité, de la répartition des risques et des incertitudes entre les sous-populations concernées. Le cas échéant, le ministre pourrait demander des mesures à inclure dans un PGR. Ces mesures et les renseignements sur l’innocuité reçus par le Ministère à la suite de ces mesures pourraient être pris en considération par le ministre dans sa surveillance continue après la mise en marché de l’innocuité de la drogue. Les mesures peuvent comprendre la façon dont les données seraient recueillies auprès de diverses populations de patients. De plus, les conditions pourraient être utilisées pour exiger que des données supplémentaires soient recueillies après l’autorisation en ce qui concerne les sous-populations de patients pour lesquelles il y a des données cliniques limitées et où l’innocuité ou l’efficacité de la drogue en question doit être mieux caractérisée. Les modifications proposées constitueraient des leviers importants pour promouvoir une prise en considération accrue de diverses sous-populations dans les essais cliniques et pour la collecte de données désagrégées supplémentaires durant la post-commercialisation.
Examens en continu
Les deux tiers des personnes touchées par des maladies rares sont des enfants. Parce qu’elles touchent un nombre relativement petit de patients, il y a une compréhension limitée en ce qui concerne leur diagnostic et leur traitementréférence 32. L’option proposée pour les examens en continu pourrait contribuer à l’approbation précoce des drogues pour le traitement de telles maladies.
De plus, bien que tout le monde soit susceptible aux maladies infectieuses, certaines populations sont vulnérables à des résultats plus graves (par exemple les adultes plus âgés, les personnes atteintes de maladies chroniques et les personnes de tout âge qui sont immunodéprimées)référence 33. L’option d’examen en continu proposé pourrait contribuer à l’autorisation précoce des drogues qui traitent une maladie infectieuse émergente et, par conséquent, profiterait à toutes les personnes au Canada, mais en particulier aux sous-populations qui sont les plus susceptibles de résultats graves et à celles qui sont plus susceptibles d’être exposées à des maladies infectieuses.
Normes et modernisation des exigences relatives aux produits biologiques
On ne s’attend pas à ce que les changements apportés aux normes aient une incidence sur les sous-populations. De plus, étant donné que les modifications proposées pour moderniser le règlement sur les produits biologiques appuient les pratiques actuelles, on ne s’attend pas à ce qu’elles aient une incidence sur la population en général.
Mise en œuvre, conformité et application, et normes de service
Mise en œuvre
Les modifications réglementaires proposées suivantes, qui accordent la priorité à la réduction du fardeau pour l’industrie et garantissent que Santé Canada est bien placé pour faire face à toute future urgence de santé publique, entreraient en vigueur au moment de l’enregistrement :
- les modifications relatives aux drogues d’urgence de santé publique (y compris les conditions, les examens en continu et le prépositionnement);
- assurer la qualité des drogues pendant la fabrication;
- la modernisation des exigences concernant les produits biologiques;
- les renseignements à l’appui de l’examen des présentations de drogue;
- les données désagrégées relatives aux essais cliniques pour les présentations de drogues nouvelles pour usage humain et les suppléments à une présentation de drogue nouvelle pour usage humain;
- les normes.
Les modifications réglementaires proposées suivantes, qui nécessitent un délai supplémentaire pour être mises en œuvre, entreraient en vigueur un an après l’enregistrement :
- les conditions (pour toutes les drogues et les instruments médicaux de classe II, III et IV);
- les plans de gestion des risques;
- les examens en continu (pour toutes les drogues sauf les drogues d’urgence de santé publique).
La modification réglementaire proposée suivante entrerait en vigueur à un moment fixé dans une future modification réglementaire une fois que le Ministère aura déterminé que les dispositions propres à la COVID-19 ne sont plus nécessaires :
- modifier la définition de drogue d’urgence de santé publique pour ne plus inclure une nouvelle drogue dont l’usage ou les conditions d’emploi recommandés par le fabricant se rapportent à la COVID-19;
- abroger d’autres dispositions spécifiques à la COVID-19.
Le Ministère prévoit mener des consultations sur les principales lignes directrices mises à jour qui accompagneraient le règlement proposé à peu près en même temps que la publication préalable du règlement dans la Partie I de la Gazette du Canada. Santé Canada publierait les documents d’orientation mis à jour au fur et à mesure qu’ils seraient finalisés sur Canada.ca.
Les lignes directrices fourniraient aux fabricants les détails sur la façon dont ils peuvent se conformer aux nouvelles dispositions proposées.
Conformité et application
La conformité et l’application du règlement proposé resteront conformes à une approche fondée sur le risque, harmonisée aux politiques ministérielles actuelles, notamment la promotion et la surveillance de la conformité et les activités d’application conformément à la Politique de conformité et d’application de la loi pour les produits de santé (POL-0001) du Ministère.
Santé Canada utilise un large éventail de mesures et d’outils de conformité et d’application de la loi. Les actions, les outils et le niveau d’intervention utilisés dépendent du contexte, de la situation et du risque pour la santé. Certaines actions et certains outils sont conçus pour aider les parties réglementées à comprendre leurs responsabilités en vertu de la loi, tandis que d’autres actions et outils sont conçus pour les inciter à se conformer à la loi. Au besoin, on utilisera des mesures d’exécution pour remédier au non-respect de la loi. Par exemple, le défaut de se conformer aux conditions constituerait une infraction à l’article 21.7 de la Loi et pourrait entraîner le Ministère à prendre des mesures de conformité et d’application de la loi conformément à la POL-0001 ou à renvoyer l’affaire au Service des poursuites pénales du Canada en vue d’une poursuite éventuelle.
Personne-ressource
Bruno Rodrigue
Directeur exécutif
Bureau de la modernisation des lois et des règlements
Direction des politiques, de la planification et des affaires internationales
Direction générale des produits de santé et des aliments
Santé Canada
Holland Cross, bureau P2108
11, avenue Holland
Ottawa (Ontario)
K1A 0K9
Indice de l’adresse : 3000A
Courriel : lrm.consultations-mlr@hc-sc.gc.ca
PROJET DE RÉGLEMENTATION
Avis est donné que la gouverneure en conseil, en vertu de l’article 30référence a de la Loi sur les aliments et drogues référence b, se propose de prendre le Règlement modifiant certains règlements pris en vertu de la Loi sur les aliments et drogues (homologation agile), ci-après.
Les intéressés peuvent présenter leurs observations au sujet du projet de règlement dans les cent jours suivant la date de publication du présent avis. Ils sont fortement encouragés à le faire au moyen de l’outil en ligne disponible à cet effet sur le site Web de la Gazette du Canada. S’ils choisissent plutôt de présenter leurs observations par courriel, par la poste ou par tout autre moyen, ils sont priés d’y citer la Partie I de la Gazette du Canada, ainsi que la date de publication du présent avis, et d’envoyer le tout à Bruno Rodrigue, directeur exécutif, Bureau de la modernisation des lois et des règlements, Direction générale des produits de santé et des aliments, ministère de la Santé, indice d’adresse 3000A, 11, avenue Holland, bureau P2108, Ottawa (Ontario) K1A 0K9 (courriel : lrm.consultations-mlr@hc-sc.gc.ca).
Ottawa, le 6 décembre 2022
La greffière adjointe du Conseil privé
Wendy Nixon
Règlement modifiant certains règlements pris en vertu de la Loi sur les aliments et drogues (homologation agile)
Règlement sur les aliments et drogues
1 L’alinéa A.01.048d) du Règlement sur les aliments et drogues référence 34 est remplacé par ce qui suit :
- d) les articles C.04.001 à C.04.006.
2 (1) Les sous-alinéas C.01.004(1)a)(iii) et (iv) du même règlement sont abrogés.
(2) Le paragraphe C.01.004(5) du même règlement est remplacé par ce qui suit :
(5) Les paragraphes (1) à (3) ne s’appliquent pas :
- a) aux drogues vendues à un fabricant de drogues;
- b) aux drogues vendues sur ordonnance dont l’étiquette porte le mode d’emploi approprié de la drogue et est conforme aux exigences de l’article C.01.005;
- c) aux drogues visées à l’annexe D de la Loi.
3 L’article C.01.011 du même règlement est modifié par adjonction, après le paragraphe (4), de ce qui suit :
(5) Le paragraphe (4) ne s’applique pas aux drogues nouvelles autres que celles qui figurent à l’annexe C de la Loi.
4 L’article C.01.014.1 du même règlement est modifié par adjonction, après le paragraphe (3), de ce qui suit :
(4) Le ministre peut demander au fabricant d’une drogue pour usage humain — autre qu’une drogue nouvelle — qui a présenté une demande en vertu du paragraphe (1) à l’égard de la drogue de lui fournir un plan de gestion des risques conforme aux exigences de l’article C.01.700 à l’égard de cette dernière s’il a des motifs raisonnables de croire :
- a) soit que le degré d’incertitude quant aux risques associés à la drogue est considérable;
- b) soit que la drogue présente un risque grave de préjudice à la santé humaine qui justifie la prise de mesures — autres que l’étiquetage — visant à diminuer la probabilité qu’un tel préjudice survienne ou à en amoindrir la gravité.
5 Le paragraphe C.01.014.2(2) du même règlement est remplacé par ce qui suit :
(2) Le ministre peut refuser de délivrer le document dans les cas suivants :
- a) il a des motifs raisonnables de croire que le produit faisant l’objet de la demande d’identification numérique n’est pas une drogue;
- b) il a des motifs raisonnables de croire que la vente de la drogue :
- (i) soit causerait un préjudice à la santé de l’acheteur ou du consommateur,
- (ii) soit contreviendrait à la Loi ou au présent règlement;
- c) dans le cas où il a demandé au fabricant de la drogue, en vertu du paragraphe C.01.014.1(4), de lui fournir un plan de gestion des risques à l’égard de celle-ci, ce dernier ne lui a pas fourni un plan de gestion des risques conforme aux exigences de l’article C.01.700.
6 (1) Le paragraphe C.01.014.21(1.1) du même règlement est remplacé par ce qui suit :
(1.1) Le ministre peut, en tout temps, assortir de conditions l’identification numérique attribuée à une drogue d’urgence de santé publique ou modifier ces conditions dans les cas suivants :
- a) un avis de conformité a été délivré en vertu de l’article C.08.004 à l’égard :
- (i) soit d’une présentation de drogue nouvelle qui a été déposée au titre de l’article C.08.002 à l’égard de la drogue d’urgence de santé publique et qui contient la mention prévue à l’alinéa C.08.002(2.1)a),
- (ii) soit d’un supplément à une telle présentation de drogue nouvelle qui a été déposé au titre de l’article C.08.003 à l’égard de la drogue d’urgence de santé publique;
- b) un avis de conformité a été délivré en vertu de l’article C.08.004 à l’égard de l’une des présentations ou de l’un des suppléments ci-après qui a été déposé à l’égard de la drogue sur la base d’une comparaison directe ou indirecte entre celle-ci et une autre drogue d’urgence de santé publique visée à l’alinéa a) :
- (i) la présentation de drogue nouvelle visée à l’article C.08.002,
- (ii) la présentation abrégée de drogue nouvelle visée à l’article C.08.002.1,
- (iii) le supplément à une présentation de drogue nouvelle ou à une présentation abrégée de drogue nouvelle visé à l’article C.08.003.
(2) La définition de drogue désignée contre la COVID-19, au paragraphe C.01.014.21(3) du même règlement, est abrogée.
(3) Le paragraphe C.01.014.21(3) du même règlement est modifié par adjonction, selon l’ordre alphabétique, de ce qui suit :
- drogue d’urgence de santé publique
- S’entend au sens de l’article C.08.001.1. (public health emergency drug)
(4) L’article C.01.014.21 du même règlement est remplacé par ce qui suit :
C.01.014.21 Le ministre peut, en tout temps, assortir de conditions l’identification numérique attribuée à une drogue ou modifier de telles conditions après avoir pris en compte les facteurs suivants :
- a) la question de savoir si les avantages ou les risques associés à la drogue font l’objet d’incertitudes importantes;
- b) la question de savoir si les exigences prévues sous le régime de la Loi sont suffisantes pour atteindre les objectifs suivants :
- (i) optimiser les avantages et gérer les risques associés à la drogue,
- (ii) gérer les incertitudes dont ces avantages et ces risques font l’objet,
- (iii) recueillir des renseignements permettant d’évaluer en continu ces avantages et ces risques, déceler tout changement à leur égard et gérer ces incertitudes;
- c) la question de savoir si les conditions projetées peuvent contribuer à l’atteinte des objectifs mentionnés aux sous-alinéas b)(i) à (iii);
- d) la question de savoir si le respect des conditions projetées est réalisable sur le plan technique;
- e) la question de savoir s’il existe des moyens moins exigeants pour atteindre les objectifs des conditions projetées.
7 Le même règlement est modifié par adjonction, après l’article C.01.625, de ce qui suit :
Plan de gestion des risques
C.01.700 Tout plan de gestion des risques fourni au ministre sous le régime du présent règlement doit tenir compte du contexte canadien et comprendre ce qui suit :
- a) la description de la drogue à laquelle le plan se rapporte et de l’utilisation à laquelle cette dernière est destinée;
- b) la description détaillée des risques associés à la drogue et des incertitudes dont ces risques font l’objet;
- c) la description détaillée des mesures que le fabricant entend prendre pour faire face à ces incertitudes et pour surveiller celles-ci;
- d) la description détaillée des mesures que le fabricant entend prendre pour prévenir ou pour réduire ces risques;
- e) la description détaillée de la façon dont le fabricant a l’intention d’évaluer l’efficacité des mesures qu’il entend prendre pour prévenir ou pour réduire ces risques;
- f) le résumé du plan, en français et en anglais.
C.01.701 (1) Le ministre peut demander au fabricant d’une drogue pour usage humain à laquelle une identification numérique a été attribuée et n’a pas été annulée de lui fournir un plan de gestion des risques conforme aux exigences de l’article C.01.700 à l’égard de la drogue si les conditions suivantes sont réunies :
- a) aucun plan de gestion des risques à l’égard de la drogue ne lui a encore été fourni;
- b) il a des motifs raisonnables de croire :
- (i) soit que le degré d’incertitude quant aux risques associés à la drogue est considérable,
- (ii) soit que la drogue présente un risque grave de préjudice à la santé humaine qui justifie la prise de mesures — autres que l’étiquetage — visant à diminuer la probabilité qu’un tel préjudice survienne ou à en amoindrir la gravité.
(2) Dans le cas où il omet de fournir au ministre un plan de gestion des risques conforme aux exigences de l’article C.01.700 à l’égard de la drogue dans le délai précisé dans la demande, le fabricant ne peut vendre la drogue tant qu’il n’a pas fourni un tel plan à ce dernier.
C.01.702 Le fabricant d’une drogue pour usage humain à laquelle une identification numérique a été attribuée et n’a pas été annulée fournit dès que possible au ministre un plan de gestion des risques à jour et conforme aux exigences de l’article C.01.700 à l’égard de la drogue dans les cas suivants :
- a) les risques associés à la drogue ou les incertitudes dont ces risques font l’objet diffèrent sensiblement de ceux qui sont décrits dans le plan existant;
- b) les mesures que le fabricant entend prendre pour faire face aux incertitudes dont les risques associés à la drogue font l’objet et pour surveiller celles-ci ou pour prévenir ou réduire ces risques diffèrent sensiblement de celles qui sont décrites dans le plan existant.
C.01.703 (1) Le ministre peut demander au fabricant d’une drogue pour usage humain à laquelle une identification numérique a été attribuée et n’a pas été annulée de lui fournir un plan de gestion des risques à jour conforme aux exigences de l’article C.01.700 à l’égard de la drogue si, compte tenu de renseignements qu’il a obtenus depuis que le plan existant lui a été fourni, il a des motifs raisonnables de croire :
- a) soit que les risques associés à la drogue ou les incertitudes dont ces risques font l’objet diffèrent sensiblement de ceux qui sont décrits dans le plan existant;
- b) soit que la drogue présente un risque grave de préjudice à la santé humaine justifiant la prise de mesures qui visent à diminuer la probabilité qu’un tel préjudice survienne ou à en amoindrir la gravité et qui diffèrent sensiblement de celles qui sont décrites dans le plan existant.
(2) Dans le cas où il omet de fournir au ministre un plan de gestion des risques à jour conforme aux exigences de l’article C.01.700 à l’égard de la drogue dans le délai précisé dans la demande, le fabricant ne peut vendre la drogue tant qu’il n’a pas fourni un tel plan à ce dernier.
8 (1) Le paragraphe C.01A.005(2) du même règlement est remplacé par ce qui suit :
(2) La demande de licence d’établissement qui vise l’une ou plusieurs des activités figurant au tableau I de l’article C.01A.008 à exercer à l’égard d’une catégorie de drogues figurant au tableau II de cet article qui inclut l’une ou plusieurs des drogues ci-après peut contenir une mention à cet égard :
- a) une drogue contre la COVID-19;
- b) une drogue fabriquée ou vendue en vue d’être utilisée relativement à une affection décrite dans la Liste d’affections qui menacent la santé publique au sens de l’article C.08.001.1 ou présentée comme pouvant l’être.
(2) Le paragraphe C.01A.005(2) du même règlement est remplacé par ce qui suit :
(2) La demande de licence d’établissement qui vise l’une ou plusieurs des activités figurant au tableau I de l’article C.01A.008 à exercer à l’égard d’une catégorie de drogues figurant au tableau II de cet article qui inclut une drogue fabriquée ou vendue en vue d’être utilisée relativement à une affection décrite dans la Liste d’affections qui menacent la santé publique au sens de l’article C.08.001.1, ou présentée comme pouvant l’être, peut contenir une mention à cet égard.
9 (1) Le paragraphe C.01A.006(1.1) du même règlement est remplacé par ce qui suit :
(1.1) La demande de modification d’une licence d’établissement qui vise l’une ou plusieurs des activités figurant au tableau I de l’article C.01A.008 à exercer à l’égard d’une catégorie de drogues figurant au tableau II de cet article qui inclut l’une ou plusieurs des drogues ci-après peut contenir une mention à cet égard :
- a) une drogue contre la COVID-19;
- b) une drogue fabriquée ou vendue en vue d’être utilisée relativement à une affection décrite dans la Liste d’affections qui menacent la santé publique au sens de l’article C.08.001.1 ou présentée comme pouvant l’être.
(2) Le paragraphe C.01A.006(1.1) du même règlement est remplacé par ce qui suit :
(1.1) La demande de modification d’une licence d’établissement qui vise l’une ou plusieurs des activités figurant au tableau I de l’article C.01A.008 à exercer à l’égard d’une catégorie de drogues figurant au tableau II de cet article qui inclut une drogue fabriquée ou vendue en vue d’être utilisée relativement à une affection décrite dans la Liste d’affections qui menacent la santé publique au sens de l’article C.08.001.1, ou présentée comme pouvant l’être, peut contenir une mention à cet égard.
10 (1) Le paragraphe C.01A.008(1.1) du même règlement est remplacé par ce qui suit :
(1.1) Lorsqu’il évalue s’il a reçu les renseignements et le matériel visés aux articles C.01A.005 à C.01A.007 à l’égard de la demande visée aux paragraphes C.01A.005(2) ou C.01A.006(1.1) qui contient la mention visée à celui de ces paragraphes qui s’applique, le ministre prend également en considération le besoin en matière de santé publique relatif à la COVID-19 ou à l’affection décrite dans la Liste d’affections qui menacent la santé publique au sens de l’article C.08.001.1, selon le cas.
(2) Le paragraphe C.01A.008(1.1) du même règlement est remplacé par ce qui suit :
(1.1) Lorsqu’il évalue s’il a reçu les renseignements et le matériel visés aux articles C.01A.005 à C.01A.007 à l’égard de la demande visée aux paragraphes C.01A.005(2) ou C.01A.006(1.1) qui contient la mention visée à celui de ces paragraphes qui s’applique, le ministre prend également en considération le besoin en matière de santé publique relatif à l’affection décrite dans la Liste d’affections qui menacent la santé publique au sens de l’article C.08.001.1.
(3) L’article C.01A.008 du même règlement est modifié par adjonction, après le paragraphe (4), de ce qui suit :
(5) Dans le cas où la demande de délivrance ou de modification d’une licence d’établissement contient, conformément aux paragraphes C.01A.005(2) ou C.01A.006(1.1), une mention faisant référence à une affection qui est ultérieurement retirée de la Liste d’affections qui menacent la santé publique au sens de l’article C.08.001.1, le ministre peut néanmoins délivrer ou modifier la licence au titre de cette demande.
11 L’article C.01A.012.1 du même règlement est modifié par adjonction, après le paragraphe (2), de ce qui suit :
(3) Il est entendu que le ministre peut exercer le pouvoir que lui confère le paragraphe (1) à l’égard de la licence d’établissement jusqu’à l’annulation de celle-ci, même si son titulaire ne mène aucune activité à l’égard de la drogue faisant l’objet de la mention contenue dans la demande au titre de laquelle la licence a été délivrée ou modifiée.
12 L’intertitre précédant l’article C.02.013 du même règlement est remplacé par ce qui suit :
Contrôle de la qualité
C.02.012.1 Chaque lot ou lot de fabrication d’une drogue est manufacturé, emballé-étiqueté, analysé et entreposé, y compris durant son transport, de façon à assurer la qualité de la drogue.
13 Le paragraphe C.02.019(4.1) du même règlement est remplacé par ce qui suit :
(4.1) Les paragraphes (1) et (2) ne s’appliquent pas au distributeur et à l’importateur d’une drogue contre la COVID-19 si le lot dont elle provient fait l’objet d’une demande au titre du paragraphe C.04.007(1).
14 L’article C.03.206 du même règlement est remplacé par ce qui suit :
C.03.206 Les articles C.01.005 et C.04.009 ne s’appliquent pas aux constituants et aux trousses.
15 Le titre 4 de la partie C du même règlement est remplacé par ce qui suit :
TITRE 4
Drogues de l’annexe D
Définitions
C.04.001 Les définitions qui suivent s’appliquent au présent titre.
- drogue
- Drogue visée à l’annexe D de la Loi qui est sous forme posologique ou ingrédient actif pouvant être utilisé dans la préparation d’une drogue visée à cette annexe. (drug)
- matériel d’origine biologique :
-
- a) Tout matériel biologique obtenu ou dérivé d’un être humain;
- b) tout animal — notamment tout insecte — ou tout matériel biologique obtenu ou dérivé d’un animal;
- c) toute plante ou tout matériel biologique obtenu ou dérivé d’une plante;
- d) tout micro-organisme — notamment toute bactérie, tout virus, tout champignon ou tout bactériophage — ou tout matériel biologique obtenu ou dérivé d’un micro-organisme. (biological source material)
- titulaire
- S’entend, à l’égard d’une identification numérique, du fabricant à qui le ministre a délivré le document qui indique cette identification en application du paragraphe C.01.014.2(1). (holder)
Interdictions de vente
C.04.002 Il est interdit au distributeur et à l’importateur d’une drogue de vendre celle-ci à moins qu’elle ait été manufacturée, emballée-étiquetée et analysée conformément au présent titre.
C.04.003 Il est interdit à la personne qui a manufacturé, emballé-étiqueté ou analysé une drogue de vendre celle-ci à moins que la personne ait accompli l’activité en question conformément au présent titre.
Matériel d’origine biologique
C.04.004 (1) Il est interdit d’utiliser du matériel d’origine biologique pour manufacturer une drogue à moins que les conditions suivantes soient remplies :
- a) le matériel est conforme aux exigences suivantes :
- (i) il est préparé et entreposé d’une manière qui convient à son utilisation dans la manufacture de la drogue,
- (ii) dans le cas où il provient d’un être humain ou d’un animal, il est prélevé sous surveillance médicale ou vétérinaire, selon le cas;
- b) la personne qui manufacture la drogue recueille les renseignements permettant la traçabilité du matériel;
- c) tout être humain ou tout animal duquel le matériel est prélevé — ou tout animal qui, en soit, constitue ce matériel — n’a aucune maladie qui fait en sorte que le matériel ne convient pas à cette fin.
(2) La personne qui utilise du matériel d’origine biologique pour manufacturer une drogue fixe la période durant laquelle elle conserve les renseignements visés à l’alinéa (1)b) en tenant compte de ce qui suit :
- a) la nature du matériel;
- b) les risques associés au matériel;
- c) la façon dont le matériel est utilisé pour manufacturer la drogue;
- d) dans le cas où le matériel est utilisé pour manufacturer une drogue sous forme posologique, l’utilisation à laquelle la drogue est destinée.
(3) La personne qui utilise du matériel d’origine biologique pour manufacturer une drogue conserve les renseignements visés à l’alinéa (1)b) pendant au moins la plus longue des périodes suivantes :
- a) cinq ans suivant la dernière utilisation du matériel pour manufacturer la drogue;
- b) la période fixée conformément au paragraphe (2).
(4) Il incombe à la personne qui utilise du matériel d’origine biologique pour manufacturer une drogue de s’assurer que le matériel est conforme aux spécifications s’y rapportant qui ont été fournies au ministre, le cas échéant, relativement à la drogue.
Prévention de la contamination
C.04.005 (1) Il incombe à la personne qui manufacture une drogue et à celle qui emballe une drogue dans un récipient immédiat de faire ce qui suit :
- a) isoler toute opération faite avec des agents infectieux dont la manipulation exige des précautions particulières, notamment des micro-organismes sporulés pathogènes;
- b) réduire le risque de contamination de tout matériel d’origine biologique et de toute drogue dans les locaux où elle manufacture ou emballe la drogue, selon le cas, notamment en prenant des mesures visant à ce que tout individu qui a accès à la zone de manufacture ou d’emballage soit protégé contre toute infection.
(2) Il est interdit à toute personne d’utiliser dans ses locaux tout procédé de laboratoire de nature diagnostique qui n’est pas isolé des opérations visant à manufacturer, emballer-étiqueter ou analyser des drogues.
Préparations de référence
C.04.006 Les préparations de référence qui servent à analyser la pureté ou l’activité d’une drogue doivent permettre de contrôler la qualité de celle-ci.
Lancement de lots
C.04.007 (1) Pour évaluer si le lot d’une drogue sous forme posologique est propre à la vente, le ministre peut demander au manufacturier, à l’emballeur-étiqueteur ou à l’importateur de la drogue ou au titulaire de l’identification numérique de lui fournir des renseignements, des échantillons de la drogue ou des ingrédients actifs de celle-ci ou tout matériel à utiliser pour effectuer des épreuves sur les échantillons.
(2) Il est interdit à la personne à qui le ministre demande de fournir des renseignements, des échantillons ou du matériel en vertu du paragraphe (1), et à toute personne à qui ce dernier notifie une telle demande, de vendre toute drogue provenant du lot visé par cette dernière, à moins que le ministre l’avise que le lot est propre à la vente.
(3) Pour l’application du présent article, propre à la vente signifie que le lot a été manufacturé, emballé-étiqueté et analysé conformément au présent règlement et de façon compatible avec les renseignements qui ont été fournis au ministre concernant la qualité et l’innocuité de la drogue en question.
Rapports périodiques sur la qualité
C.04.008 À la demande du ministre, le titulaire de l’identification numérique attribuée à une drogue sous forme posologique lui fournit, chaque année ou à tout intervalle plus long précisé par le ministre, des renseignements sur la qualité de la drogue et des ingrédients actifs de celle-ci, y compris des renseignements sur la régularité des processus de manufacture et d’emballage de la drogue et des ingrédients.
Étiquetage
C.04.009 (1) Les renseignements ci-après doivent figurer sur l’espace principal des étiquettes intérieure et extérieure d’une drogue sous forme posologique :
- a) le nom propre de la drogue, si elle en a un, lequel est inscrit immédiatement avant ou après la marque nominative, si elle en a une, en caractères d’une taille au moins égale à la moitié de celle des caractères de la marque nominative;
- b) le nom usuel de la drogue, à défaut d’un nom propre;
- c) la quantité nette de la drogue dans l’emballage;
- d) s’agissant d’une drogue qui doit être stérile selon le présent règlement, les mentions « stérile » et « sterile »;
- e) dans le cas où le matériel d’origine biologique utilisé pour manufacturer la drogue ou ses ingrédients actifs a été obtenu ou dérivé d’un être humain, une indication à cet effet;
- f) dans le cas où le matériel d’origine biologique utilisé pour manufacturer la drogue ou ses ingrédients actifs a été obtenu ou dérivé d’un animal, l’espèce d’origine.
(2) Les renseignements ci-après doivent figurer sur un espace quelconque des étiquettes intérieure et extérieure d’une drogue sous forme posologique :
- a) le nom du titulaire de l’identification numérique attribuée à la drogue;
- b) l’activité de la drogue, s’il y a lieu;
- c) la dose recommandée de la drogue;
- d) le numéro de lot de la drogue;
- e) sous réserve du paragraphe (7), la date limite d’utilisation de la drogue;
- f) sous réserve du paragraphe (3), le mode d’emploi de la drogue;
- g) sous réserve du paragraphe (4), tout autre renseignement nécessaire en vue de prévenir un préjudice à la santé humaine.
(3) L’alinéa (2)f) ne s’applique pas si le mode d’emploi de la drogue doit figurer sur l’étiquette selon les articles C.01.004.02 ou C.01.004.03.
(4) Malgré l’alinéa (2)g), dans le cas où une autre disposition du présent règlement prévoit qu’un renseignement visé à cet alinéa doit figurer sur un espace particulier d’une étiquette, le renseignement doit figurer sur cet espace.
(5) Les renseignements ci-après doivent figurer sur un espace quelconque de l’étiquette extérieure d’une drogue sous forme posologique :
- a) l’adresse du titulaire de l’identification numérique attribuée à la drogue;
- b) la liste quantitative des agents de conservation contenus dans la drogue, le cas échéant, identifiés par leur nom propre ou, à défaut, par leur nom usuel;
- c) les conditions approuvées d’entreposage de la drogue;
- d) tout gabarit ou autre renseignement nécessaires en vue de permettre l’entreposage et la manutention convenables de la drogue;
- e) dans le cas d’une drogue nouvelle pour usage exceptionnel à l’égard de laquelle un avis de conformité a été délivré en application de l’article C.08.004.01, la mention suivante, inscrite en majuscules et de façon lisible :
« SANTÉ CANADA A AUTORISÉ LA VENTE DE CETTE DROGUE NOUVELLE POUR USAGE EXCEPTIONNEL AUX FINS DE [indication de la fin] EN SE FONDANT SUR DES ESSAIS CLINIQUES RESTREINTS CHEZ L’ÊTRE HUMAIN.
HEALTH CANADA HAS AUTHORIZED THE SALE OF THIS EXTRAORDINARY USE NEW DRUG FOR [naming purpose] BASED ON LIMITED CLINICAL TESTING IN HUMANS. ».
(6) Dans le cas où le récipient immédiat d’une drogue sous forme posologique est trop petit pour avoir une étiquette intérieure conforme aux exigences du présent règlement, les exigences de ce dernier relatives à l’étiquette intérieure ne s’appliquent pas si les conditions suivantes sont réunies :
- a) il y a une étiquette extérieure conforme aux exigences du présent règlement;
- b) les renseignements ci-après figurent sur l’étiquette intérieure :
- (i) le nom propre de la drogue ou, à défaut, son nom usuel ou, s’il s’agit d’une drogue contenant plus d’un ingrédient actif, sa marque nominative,
- (ii) le nom du titulaire de l’identification numérique attribuée à la drogue,
- (iii) l’activité de la drogue, s’il y a lieu, sauf si la drogue contient plus d’un ingrédient actif et sa marque nominative est unique en ce qui a trait à une activité particulière de la drogue,
- (iv) le numéro de lot de la drogue,
- (v) sous réserve du paragraphe (7), la date limite d’utilisation de la drogue,
- (vi) la voie d’administration de la drogue,
- (vii) tout renseignement nécessaire en vue de prévenir un préjudice à la santé humaine, s’il y a lieu,
- (viii) la quantité nette de la drogue dans le récipient.
(7) L’étiquette d’une drogue stockée en vue de son utilisation en cas d’urgence peut ne pas indiquer la date limite d’utilisation visée à l’alinéa (2)e) et au sous-alinéa (6)b)(v) si un autre moyen pour communiquer cette date aux individus qui administrent la drogue est fourni.
Étiquetage des drogues sur ordonnance
C.04.010 (1) L’emballage d’une drogue sous forme posologique qui est une drogue sur ordonnance doit porter le symbole « Pr » dans le quart supérieur gauche de l’espace principal des étiquettes intérieure et extérieure ou, dans le cas d’un récipient à dose unique, dans le quart supérieur gauche de l’espace principal de l’étiquette extérieure.
(2) Le paragraphe (1) ne s’applique pas :
- a) aux drogues vendues au titulaire d’une licence d’établissement délivrée aux termes du titre 1A;
- b) aux drogues vendues sur ordonnance.
16 (1) La définition de drogue désignée contre la COVID-19, à l’article C.08.001.1 du même règlement, est abrogée.
(2) L’article C.08.001.1 du même règlement est modifié par adjonction, selon l’ordre alphabétique, de ce qui suit :
- drogue d’urgence de santé publique
- Drogue nouvelle dont les fins et le mode d’emploi recommandés par le fabricant ont trait à la COVID-19 ou à une affection décrite dans la Liste d’affections qui menacent la santé publique. (public health emergency drug)
- Liste d’affections qui menacent la santé publique
- La Liste d’affections qui menacent la santé publique au Canada, publiée sur le site Web du gouvernement du Canada, avec ses modifications successives. (List of Conditions that Threaten Public Health)
(3) La définition de drogue d’urgence de santé publique, à l’article C.08.001.1 du même règlement, est remplacée par ce qui suit :
- drogue d’urgence de santé publique
- Drogue nouvelle dont les fins et le mode d’emploi recommandés par le fabricant ont trait à une affection décrite dans la Liste d’affections qui menacent la santé publique. (public health emergency drug)
17 Le même règlement est modifié par adjonction, après l’article C.08.001.1, de ce qui suit :
C.08.001.2 Le ministre ne peut ajouter une affection à la Liste d’affections qui menacent la santé publique que s’il a des motifs raisonnables de croire, à la fois :
- a) que l’affection présente un risque appréciable pour la santé publique au Canada ou en résulte;
- b) qu’une intervention immédiate est nécessaire pour parer au risque.
C.08.001.3 En cas de retrait d’une affection de la Liste d’affections qui menacent la santé publique après le dépôt, conformément aux paragraphes C.08.002(2) à (2.5) et à l’article C.08.005.1, d’une présentation de drogue nouvelle à l’égard d’une drogue d’urgence de santé publique relative à cette affection, mais avant que le ministre rende une décision définitive à l’égard de la présentation en application de l’article C.08.004, la drogue demeure une drogue d’urgence de santé publique pour l’application du présent titre tant que le ministre n’a pas rendu sa décision.
18 (1) L’alinéa C.08.002(2)o) du même règlement est remplacé par ce qui suit :
- o) dans le cas d’une drogue nouvelle pour usage humain autre qu’une drogue d’urgence de santé publique, une appréciation de la question de savoir si la drogue nouvelle est susceptible d’être confondue avec une autre drogue à laquelle une identification numérique a été attribuée en raison de la ressemblance de la marque nominative dont l’utilisation est proposée pour cette drogue nouvelle avec la marque nominative, le nom usuel ou le nom propre de l’autre drogue.
(2) Le paragraphe C.08.002(2) du même règlement est modifié par adjonction, après l’alinéa o), de ce qui suit :
- p) dans le cas d’une drogue nouvelle pour usage humain, un plan de gestion des risques conforme aux exigences de l’article C.01.700 à l’égard de la drogue, si l’une des conditions suivantes est remplie :
- (i) le degré d’incertitude quant aux risques associés à la drogue est considérable,
- (ii) la drogue présente un risque grave de préjudice à la santé humaine qui justifie la prise de mesures — autres que l’étiquetage — visant à diminuer la probabilité qu’un tel préjudice survienne ou à en amoindrir la gravité.
(3) Les paragraphes C.08.002(2.1) à (2.5) du même règlement sont remplacés par ce qui suit :
(2.01) Les données d’essais cliniques fournies dans une présentation de drogue nouvelle au titre des alinéas (2)g) ou h) ou (2.1)b) qui sont ventilées par sous-groupes de population dans une demande d’autorisation de vente de la drogue présentée à l’Agence européenne des médicaments ou au Secrétariat américain aux produits alimentaires et pharmaceutiques doivent être ventilées de la même façon dans la présentation de drogue nouvelle.
(2.1) Le fabricant peut déposer, à l’égard d’une drogue d’urgence de santé publique, une présentation de drogue nouvelle qui n’est pas conforme aux exigences des alinéas (2)g) et h) si la présentation contient à la fois :
- a) une mention portant que la présentation contient les preuves visées à l’alinéa b);
- b) des preuves suffisantes pour conclure que les avantages associés à la drogue l’emportent sur les risques associés à cette dernière en ce qui a trait aux fins et selon le mode d’emploi recommandés, compte tenu des incertitudes dont ces avantages et ces risques font l’objet et du besoin en matière de santé publique relatif à la COVID-19 ou à l’affection en cause décrite dans la Liste d’affections qui menacent la santé publique, selon le cas.
(2.2) Le fabricant peut déposer, à l’égard d’une drogue d’urgence de santé publique pour usage humain, une présentation de drogue nouvelle qui n’est pas conforme aux exigences de l’alinéa (2)j.1) si la présentation contient une maquette de toute étiquette à utiliser relativement à la drogue, y compris toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue qui est fournie sur demande.
(2.3) Si, au moment de déposer sa présentation de drogue nouvelle à l’égard d’une drogue d’urgence de santé publique, le fabricant ne peut fournir au ministre les renseignements ou le matériel visés à l’un des alinéas (2)e) à k), m) et n), à l’alinéa (2.1)b), au paragraphe (2.2) ou à l’article C.08.005.1 ou qu’il fournit ces renseignements ou ce matériel mais de façon incomplète, il fournit au ministre, au même moment, un plan précisant les modalités selon lesquelles il lui fournira les renseignements ou le matériel manquants.
(2.4) Les paragraphes (2.1) à (2.3) s’appliquent seulement si, à la fois :
- a) la présentation de drogue nouvelle contient une mention portant que la présentation vise une drogue d’urgence de santé publique;
- b) les fins et le mode d’emploi mentionnés dans la présentation de drogue nouvelle ont trait uniquement à la COVID-19 ou à une affection décrite dans la Liste d’affections qui menacent la santé publique et la présentation contient une mention à cet égard.
(2.5) Les paragraphes (2.1) à (2.3) ne s’appliquent pas lorsque le fabricant demande un avis de conformité à l’égard de la drogue d’urgence de santé publique sur la base d’une comparaison directe ou indirecte entre celle-ci et une autre drogue d’urgence de santé publique.
(4) L’alinéa C.08.002(2.1)b) du même règlement est remplacé par ce qui suit :
- b) des preuves suffisantes pour conclure que les avantages associés à la drogue l’emportent sur les risques associés à cette dernière en ce qui a trait aux fins et selon le mode d’emploi recommandés, compte tenu des incertitudes dont ces avantages et ces risques font l’objet et du besoin en matière de santé publique relatif à l’affection applicable décrite dans la Liste d’affections qui menacent la santé publique.
(5) Le paragraphe C.08.002(2.3) du même règlement est remplacé par ce qui suit :
(2.3) Si, au moment de déposer sa présentation de drogue nouvelle à l’égard d’une drogue d’urgence de santé publique, le fabricant ne peut fournir au ministre les renseignements ou le matériel visés à l’un des alinéas (2)e) à k), m), n) et p), à l’alinéa (2.1)b), au paragraphe (2.2) ou à l’article C.08.005.1 ou qu’il fournit ces renseignements ou ce matériel mais de façon incomplète, il fournit au ministre, au même moment, un plan précisant les modalités selon lesquelles il lui fournira les renseignements ou le matériel manquants.
(6) L’alinéa C.08.002(2.4)b) du même règlement est remplacé par ce qui suit :
- b) les fins et le mode d’emploi mentionnés dans la présentation de drogue nouvelle ont trait uniquement à une affection décrite dans la Liste d’affections qui menacent la santé publique et la présentation contient une mention à cet égard.
(7) L’article C.08.002 du même règlement est modifié par adjonction, après le paragraphe (3), de ce qui suit :
(4) Le fabricant peut déposer une présentation de drogue nouvelle qui ne contient pas encore l’ensemble des renseignements visés aux alinéas (2)g) à i), m), n) et p) — et l’ensemble des renseignements connexes à y inclure en application de l’article C.08.005.1, s’il y a lieu —, si les conditions suivantes sont réunies :
- a) il fournit ce qui suit au ministre avant de déposer la présentation :
- (i) des renseignements établissant que les conditions prévues à l’un des alinéas (5)a) à c) sont remplies,
- (ii) un plan précisant les modalités selon lesquelles il propose de fournir au ministre les renseignements manquants pendant la période de cent cinquante-cinq jours qui commence à la date du dépôt de la présentation,
- (iii) des renseignements établissant qu’il a en sa possession une quantité appréciable de preuves en vue d’établir l’innocuité de la drogue nouvelle aux fins et selon le mode d’emploi recommandés,
- (iv) des renseignements établissant qu’il a en sa possession une quantité appréciable de preuves en vue d’établir l’efficacité clinique de la drogue nouvelle aux fins et selon le mode d’emploi recommandés,
- (v) dans le cas où il demandera la délivrance de l’avis de conformité sur la base d’une comparaison directe ou indirecte entre la drogue nouvelle et une autre drogue à laquelle une identification numérique a été attribuée, cette identification numérique;
- b) le ministre lui fournit un avis qui précise les modalités selon lesquelles il doit fournir les renseignements manquants pendant la période de cent cinquante-cinq jours prévue au sous-alinéa a)(ii);
- c) la présentation est conforme aux exigences suivantes :
- (i) elle contient les preuves visées aux sous-alinéas a)(iii) et (iv),
- (ii) son dépôt a lieu dans les soixante jours suivant le jour où le ministre fournit cet avis au fabricant.
(5) Pour l’application des sous-alinéas (4)a)(i) et C.08.003(5)a)(i), les conditions sont les suivantes :
- a) la drogue nouvelle est nécessaire pour diagnostiquer, traiter, atténuer ou prévenir une maladie infectieuse émergente qui présente ou peut présenter un risque grave de préjudice à la santé humaine ou animale;
- b) la drogue nouvelle est destinée à être utilisée pour diagnostiquer, traiter, atténuer ou prévenir une maladie, un désordre ou un état physique anormal qui présente ou peut présenter un risque grave de préjudice à la santé humaine ou animale, et les fins et le mode d’emploi recommandés de la drogue ne figurent pas parmi ceux de toute autre drogue à laquelle une identification numérique a été attribuée et n’a pas été annulée;
- c) la drogue nouvelle est destinée à être utilisée pour diagnostiquer, traiter, atténuer ou prévenir une maladie, un désordre ou un état physique anormal qui présente ou peut présenter un risque grave de préjudice à la santé humaine ou animale et les fins et le mode d’emploi recommandés de la drogue figurent parmi ceux d’une ou de plusieurs autres drogues auxquelles une identification numérique a été attribuée et n’a pas été annulée, mais il y a des motifs raisonnables de croire qu’elle est sensiblement plus efficace ou qu’elle présente un risque sensiblement plus faible que chacune de ces autres drogues.
(6) Le ministre fournit l’avis prévu à l’alinéa (4)b) au fabricant si, à la fois :
- a) le fabricant lui a fourni les renseignements visés à l’alinéa (4)a);
- b) le ministre n’a pas de motifs de croire que le fabricant ne sera pas en mesure de lui fournir les renseignements manquants conformément à l’avis.
(7) La présentation de drogue nouvelle déposée conformément au paragraphe (4) est considérée comme ayant été annulée par le fabricant dans les cas suivants :
- a) il n’a pas fourni au ministre certains des renseignements mentionnés dans l’avis prévu à l’alinéa (4)b) dans les dix jours suivant celle des dates précisées dans l’avis qui s’applique, ou dans tout délai plus long précisé par le ministre, ou il ne sera pas en mesure de le faire;
- b) il demande la délivrance de l’avis de conformité sur la base d’une comparaison directe ou indirecte entre la drogue nouvelle et une autre drogue à laquelle une identification numérique a été attribuée, mais il a omis de fournir cette identification numérique au ministre avant de déposer la présentation.
(8) Le fabricant d’une drogue nouvelle pour usage vétérinaire seulement peut déposer, à l’égard de celle-ci, une présentation de drogue nouvelle qui ne contient pas encore l’ensemble des renseignements visés aux alinéas (2)d) à j), aux sous-alinéas (2)k)(ii) et (iv) et aux alinéas (2)m) et n) — et l’ensemble des renseignements connexes à y inclure en application de l’article C.08.005.1, s’il y a lieu —, si les conditions suivantes sont réunies :
- a) le ministre lui a indiqué son intention d’examiner la présentation avec une autorité réglementaire étrangère au sens du paragraphe C.10.001(1);
- b) au moment du dépôt, la présentation contient ce qui suit :
- (i) un plan précisant les modalités selon lesquelles il fournira au ministre les renseignements manquants,
- (ii) à tout le moins certains des renseignements visés à l’un des alinéas (2)d) à h), m) et n),
- (iii) dans le cas où le fabricant demande la délivrance de l’avis de conformité sur la base d’une comparaison directe ou indirecte entre la drogue nouvelle et une autre drogue à laquelle une identification numérique a été attribuée, cette identification numérique.
(9) La présentation de drogue nouvelle déposée conformément au paragraphe (8) est considérée comme ayant été annulée par le fabricant dans les cas suivants :
- a) il avise le ministre qu’il ne veut plus que ce dernier examine la présentation avec l’autorité réglementaire étrangère;
- b) il demande la délivrance de l’avis de conformité sur la base d’une comparaison directe ou indirecte entre la drogue en question et une autre drogue à laquelle une identification numérique a été attribuée, mais il a omis de fournir cette identification numérique au ministre au moment de déposer la présentation.
19 L’alinéa C.08.002.01(2)b) du même règlement est modifié par adjonction, après le sous-alinéa (x), de ce qui suit :
- (xi) un plan de gestion des risques conforme aux exigences de l’article C.01.700 à l’égard de la drogue nouvelle.
20 Le paragraphe C.08.002.1(2) du même règlement est modifié par adjonction, après l’alinéa a), de ce qui suit :
- a.1) dans le cas d’une drogue nouvelle pour usage humain, un plan de gestion des risques conforme aux exigences de l’article C.01.700 à l’égard de la drogue, si l’une des conditions prévues aux sous-alinéas C.08.002(2)p)(i) et (ii) est remplie;
21 (1) Le paragraphe C.08.003(2) du même règlement est modifié par adjonction, après l’alinéa b), de ce qui suit :
- b.1) dans le cas d’un vaccin contre l’influenza mentionné dans la Liste des vaccins contre l’influenza pouvant faire l’objet de suppléments à une présentation de drogue nouvelle, publiée sur le site Web du gouvernement du Canada, avec ses modifications successives, les souches auxquelles le vaccin se rapporte;
(2) L’article C.08.003 du même règlement est modifié par adjonction, après le paragraphe (3), de ce qui suit :
(3.01) Les données d’essais cliniques fournies dans le supplément à une présentation de drogue nouvelle qui sont ventilées par sous-groupes de population dans une demande d’autorisation de vente de la drogue présentée à l’Agence européenne des médicaments ou au Secrétariat américain aux produits alimentaires et pharmaceutiques doivent être ventilées de la même façon dans le supplément.
(3) L’article C.08.003 du même règlement est modifié par adjonction, après le paragraphe (4), de ce qui suit :
(5) Le fabricant d’une drogue nouvelle à l’égard de laquelle une présentation de drogue nouvelle a été déposée peut déposer un supplément à cette présentation qui ne contient pas encore l’ensemble des renseignements et du matériel visés au paragraphe (3) — et l’ensemble des renseignements connexes à y inclure en application de l’article C.08.005.1, s’il y a lieu —, si les conditions suivantes sont réunies :
- a) il fournit au ministre ce qui suit avant de déposer le supplément :
- (i) des renseignements établissant que les conditions prévues à l’un des alinéas C.08.002(5)a) à c) sont remplies,
- (ii) un plan précisant les modalités selon lesquelles il propose de fournir au ministre les renseignements ou le matériel manquants pendant la période de cent cinquante-cinq jours qui commence à la date du dépôt du supplément,
- (iii) des renseignements établissant qu’il a en sa possession une quantité appréciable des renseignements et du matériel visés au paragraphe (3),
- (iv) dans le cas où il demandera la délivrance de l’avis de conformité sur la base d’une comparaison directe ou indirecte entre la drogue en question et une autre drogue à laquelle une identification numérique a été attribuée, cette identification numérique;
- b) le ministre lui fournit un avis qui précise les modalités selon lesquelles il doit fournir les renseignements ou le matériel manquants pendant la période de cent cinquante-cinq jours prévue au sous-alinéa a)(ii);
- c) le supplément est conforme aux exigences suivantes :
- (i) il contient les renseignements et le matériel visés au paragraphe (3) que le fabricant avait en sa possession au moment de fournir des renseignements au ministre au titre du sous-alinéa a)(iii),
- (ii) son dépôt a lieu dans les soixante jours suivant le jour où le ministre fournit cet avis au fabricant.
(6) Le ministre fournit l’avis prévu à l’alinéa (5)b) au fabricant si, à la fois :
- a) le fabricant lui a fourni les renseignements visés à l’alinéa (5)a);
- b) le ministre n’a pas de motifs de croire que le fabricant ne sera pas en mesure de lui fournir les renseignements ou le matériel manquants conformément à l’avis.
(7) Le supplément déposé conformément au paragraphe (5) est considéré comme ayant été annulé par le fabricant dans les cas suivants :
- a) il n’a pas fourni au ministre certains des renseignements ou du matériel mentionnés dans l’avis prévu à l’alinéa (5)b) dans les dix jours suivant celle des dates précisées dans l’avis qui s’applique, ou dans tout délai plus long précisé par le ministre, ou il ne sera pas en mesure de le faire;
- b) il demande la délivrance de l’avis de conformité sur la base d’une comparaison directe ou indirecte entre la drogue nouvelle et une autre drogue à laquelle une identification numérique a été attribuée, mais il a omis de fournir cette identification numérique au ministre avant de déposer le supplément.
(8) Le fabricant d’une drogue nouvelle pour usage vétérinaire seulement à l’égard de laquelle une présentation de drogue nouvelle a été déposée peut déposer un supplément à cette présentation qui ne contient pas encore l’ensemble des renseignements et du matériel visés au paragraphe (3) — et l’ensemble des renseignements connexes à y inclure en application de l’article C.08.005.1, s’il y a lieu —, si les conditions suivantes sont réunies :
- a) le ministre lui a indiqué son intention d’examiner le supplément avec une autorité réglementaire étrangère au sens du paragraphe C.10.001(1);
- b) au moment du dépôt, le supplément contient ce qui suit :
- (i) un plan précisant les modalités selon lesquelles il fournira au ministre les renseignements ou le matériel manquants,
- (ii) certains des renseignements ou du matériel visés au paragraphe (3),
- (iii) dans le cas où il demande la délivrance de l’avis de conformité sur la base d’une comparaison directe ou indirecte entre la drogue en question et une autre drogue à laquelle une identification numérique a été attribuée, cette identification numérique.
(9) Le supplément déposé conformément au paragraphe (8) est considéré comme ayant été annulé par le fabricant dans les cas suivants :
- a) il avise le ministre qu’il ne veut plus que ce dernier examine le supplément avec l’autorité réglementaire étrangère;
- b) il demande la délivrance de l’avis de conformité sur la base d’une comparaison directe ou indirecte entre la drogue en question et une autre drogue à laquelle une identification numérique a été attribuée, mais il a omis de fournir cette identification numérique au ministre au moment de déposer le supplément.
(10) Le fabricant d’un vaccin mentionné dans la liste mentionnée à l’alinéa (2)b.1) peut déposer un supplément à la présentation de drogue nouvelle déposée à l’égard du vaccin qui ne contient pas encore l’ensemble des renseignements et du matériel visés au paragraphe (3) — et l’ensemble des renseignements connexes à y inclure en application de l’article C.08.005.1, s’il y a lieu —, si le supplément se rapporte à l’élément visé à cet alinéa.
22 L’article C.08.003.1 du même règlement est remplacé par ce qui suit :
C.08.003.1 Dans le cadre de son examen d’une présentation de drogue nouvelle, d’une présentation de drogue nouvelle pour usage exceptionnel, d’une présentation abrégée de drogue nouvelle, d’une présentation abrégée de drogue nouvelle pour usage exceptionnel ou d’un supplément à l’une de ces présentations, le ministre peut examiner les renseignements ou le matériel ci-après pour évaluer l’innocuité et l’efficacité de la drogue nouvelle visée par la présentation ou le supplément :
- a) ceux que toute personne a fournis sous le régime de la Loi;
- b) ceux obtenus de tout lieu de fabrication, d’emballage, d’étiquetage ou d’analyse — en cours ou à venir — de la drogue nouvelle ou de tout ingrédient actif de celle-ci au sens du paragraphe C.01A.001(1);
- c) ceux obtenus — directement ou indirectement — d’une autorité réglementaire étrangère au sens du paragraphe C.10.001(1).
23 Le même règlement est modifié par adjonction, après l’article C.08.003.1, de ce qui suit :
C.08.003.2 Il est entendu que le fabricant peut être assujetti à l’obligation de fournir le plan de gestion des risques visé à l’alinéa C.08.002(2)p), au sous-alinéa C.08.002.01(2)b)(ix) ou à l’alinéa C.08.002.1(2)a.1) à tout moment avant que le ministre rende une décision définitive en application des articles C.08.004 ou C.08.004.01, selon le cas.
24 L’intertitre précédant l’article C.08.009.01 du même règlement est remplacé par ce qui suit :
Prépositionnement de drogues d’urgence de santé publique
25 L’article C.08.009.01 du même règlement est modifié par adjonction, selon l’ordre alphabétique, de ce qui suit :
- classe de forme posologique
- S’entend au sens du paragraphe C.01A.001(1). (dosage form class)
- emballer-étiqueter
- S’entend au sens du paragraphe C.01A.001(1). (package/label)
- manufacturer
- S’entend au sens du paragraphe C.01A.001(1). (fabricate)
26 L’article C.08.009.02 du même règlement est remplacé par ce qui suit :
C.08.009.02 Les articles C.08.009.03 à C.08.009.05 s’appliquent à l’égard d’une drogue d’urgence de santé publique si les conditions suivantes sont réunies :
- a) aucun avis de conformité n’a été délivré à son égard en application des articles C.08.004 ou C.08.004.01;
- b) Sa Majesté du chef du Canada a conclu un contrat en vue de son acquisition.
27 Le paragraphe C.08.009.03(1) du même règlement est remplacé par ce qui suit :
C.08.009.03 (1) Le titulaire d’une licence d’établissement peut importer une drogue d’urgence de santé publique si les conditions suivantes sont réunies :
- a) l’administrateur en chef de la santé publique fournit au ministre :
- (i) de l’information selon laquelle la drogue fait l’objet d’une présentation de drogue nouvelle ou d’une demande d’autorisation de vente présentée à une autorité réglementaire étrangère,
- (ii) le nom et la description de la drogue,
- (iii) les nom et coordonnées du fabricant de la drogue,
- (iv) de l’information quant à la quantité de la drogue à importer,
- (v) les nom et coordonnées du titulaire de licence,
- (vi) l’adresse municipale du lieu où la drogue sera entreposée après l’importation;
- b) le titulaire de licence fournit au ministre :
- (i) les nom et coordonnées de chaque manufacturier, emballeur-étiqueteur et analyste de la drogue et l’adresse municipale de chaque bâtiment où celle-ci sera manufacturée, emballée-étiquetée ou analysée, avec indication, pour chaque bâtiment, de ce qui suit :
- (A) les activités mentionnées au tableau I de l’article C.01A.008 qui s’appliquent à la drogue,
- (B) les catégories mentionnées au tableau II de cet article qui s’appliquent à la drogue,
- (C) pour chacune de ces catégories, la classe de forme posologique, le cas échéant, et une mention indiquant s’il s’agit d’une drogue stérile,
- (ii) le certificat d’un inspecteur indiquant que les bâtiments, l’équipement et les méthodes et pratiques de chaque manufacturier, emballeur-étiqueteur et analyste satisfont aux exigences applicables des titres 2 à 4 ou, à défaut, toute autre preuve établissant qu’il est satisfait à ces exigences;
- (i) les nom et coordonnées de chaque manufacturier, emballeur-étiqueteur et analyste de la drogue et l’adresse municipale de chaque bâtiment où celle-ci sera manufacturée, emballée-étiquetée ou analysée, avec indication, pour chaque bâtiment, de ce qui suit :
- c) la drogue appartient à une catégorie de drogues que la licence permet d’importer.
28 (1) Le passage de l’article C.08.009.04 du même règlement précédant l’alinéa a) est remplacé par ce qui suit :
C.08.009.04 Les articles A.01.040, C.01.004.1 et C.01A.006 et, à l’exception des dispositions ci-après, les titres 2 à 4 ne s’appliquent pas à l’égard de l’importation, au titre de l’article C.08.009.03, d’une drogue d’urgence de santé publique :
(2) L’article C.08.009.04 du même règlement est modifié par adjonction, après l’alinéa b), de ce qui suit :
- b.1) l’article C.02.012.1 en ce qui a trait à l’entreposage de la drogue par le titulaire de licence;
(3) L’alinéa C.08.009.04j) du même règlement est abrogé.
29 Le passage de l’article C.08.009.05 du même règlement précédant l’alinéa a) est remplacé par ce qui suit :
C.08.009.05 Malgré toute disposition du présent règlement, le titulaire d’une licence d’établissement peut distribuer une drogue d’urgence de santé publique qu’il a importée en vertu de l’article C.08.009.03 si les conditions suivantes sont réunies :
30 (1) Le paragraphe C.08.011.2(2) du même règlement est modifié par adjonction, après l’alinéa c), de ce qui suit :
- c.1) l’article C.02.012.1 en ce qui a trait à l’entreposage de la drogue nouvelle par le titulaire d’une licence d’établissement;
(2) L’alinéa C.08.011.2(2)k) du même règlement est abrogé.
31 (1) Le paragraphe C.10.001(5) du même règlement est modifié par adjonction, après l’alinéa c), de ce qui suit :
- c.1) l’article C.02.012.1 en ce qui a trait à l’entreposage de la drogue par le titulaire;
(2) L’alinéa C.10.001(5)k) du même règlement est abrogé.
32 Le paragraphe C.10.002(2) du même règlement est modifié par adjonction, après l’alinéa c), de ce qui suit :
- c.1) l’article C.02.012.1 en ce qui a trait à l’entreposage de la drogue par le titulaire;
33 Dans les passages ci-après du même règlement, « drogue désignée contre la COVID-19 » est remplacé par « drogue » :
- a) les alinéas C.08.009.04a), d) et e);
- b) les alinéas C.08.009.05a) et b).
Règlement sur les instruments médicaux
34 Les paragraphes 36(2) à (4) du Règlement sur les instruments médicaux référence 35 sont remplacés par ce qui suit :
(2) Le ministre peut, en tout temps, assortir de conditions l’homologation délivrée à l’égard d’un instrument médical ou modifier de telles conditions après avoir pris en compte les facteurs suivants :
- a) la question de savoir si les avantages ou les risques associés à l’instrument font l’objet d’incertitudes;
- b) la question de savoir si les exigences prévues sous le régime de la Loi sont suffisantes pour atteindre les objectifs suivants :
- (i) maintenir la sûreté et l’efficacité de l’instrument,
- (ii) optimiser les avantages et gérer les risques associés à l’instrument,
- (iii) déceler tout changement et gérer les incertitudes dont les avantages et les risques associés à l’instrument font l’objet;
- c) la question de savoir si les conditions projetées peuvent contribuer à l’atteinte des objectifs mentionnés aux sous-alinéas b)(i) à (iii);
- d) la question de savoir si le respect des conditions projetées est réalisable sur le plan technique;
- e) la question de savoir s’il existe des moyens moins exigeants pour atteindre les objectifs des conditions projetées.
35 L’article 37 du même règlement est remplacé par ce qui suit :
37 Si les conditions dont l’homologation d’un instrument diagnostique in vitro est assortie prévoient que des essais soient effectués pour veiller à ce que l’instrument satisfasse toujours aux exigences applicables prévues aux articles 10 à 20, il est interdit de vendre tout instrument provenant de tout lot de l’instrument diagnostique in vitro sauf si, à la fois :
- a) le protocole d’essai et les résultats des essais effectués sur des instruments faisant partie du lot ont été fournis au ministre;
- b) le ministre conclut, selon les renseignements qui lui ont été fournis en application de l’alinéa a), que les instruments faisant partie du lot satisfont toujours aux exigences applicables prévues aux articles 10 à 20.
Règlement modifiant le Règlement sur les aliments et drogues (Arrêté d’urgence concernant l’importation, la vente et la publicité de drogues à utiliser relativement à la COVID-19)
36 L’alinéa 20e) du Règlement modifiant le Règlement sur les aliments et drogues (Arrêté d’urgence concernant l’importation, la vente et la publicité de drogues à utiliser relativement à la COVID-19) référence 36 est remplacé par ce qui suit :
- e) les articles C.04.004, C.04.005, C.04.007, C.04.009 et C.04.010.
Dispositions transitoires
37 Sauf indication contraire du contexte, les termes utilisés dans les articles 38 à 43 s’entendent au sens du Règlement sur les aliments et drogues.
38 (1) Les conditions dont toute identification numérique est assortie en vertu du paragraphe C.01.014.21(1.1) du Règlement sur les aliments et drogues, dans sa version antérieure à la date d’entrée en vigueur du paragraphe 6(1) du présent règlement, qui s’appliquent immédiatement avant cette date continuent de s’appliquer et peuvent être modifiées par le ministre en vertu du paragraphe C.01.014.21(1.1) du Règlement sur les aliments et drogues, dans sa version à cette date ou après celle-ci.
(2) Les conditions dont toute identification numérique est assortie en vertu des paragraphes C.01.014.21(1) ou (1.1) du Règlement sur les aliments et drogues, dans leur version antérieure à la date d’entrée en vigueur du paragraphe 6(4) du présent règlement, qui s’appliquent immédiatement avant cette date continuent de s’appliquer et peuvent être modifiées par le ministre en vertu de l’article C.01.014.21 du Règlement sur les aliments et drogues, dans sa version à cette date ou après celle-ci.
39 (1) Les mentions de « plan existant » à l’article C.01.702 et au paragraphe C.01.703(1) du Règlement sur les aliments et drogues valent mention, dans le cas d’une drogue à l’égard de laquelle un plan de gestion des risques a été fourni au ministre avant la date d’entrée en vigueur de l’article 7 du présent règlement, de la version la plus récente du plan.
(2) Le paragraphe (1) cesse de s’appliquer à l’égard d’une drogue lorsqu’un plan de gestion des risques à jour est fourni au ministre à l’égard de la drogue conformément aux articles C.01.702 ou C.01.703 du Règlement sur les aliments et drogues.
40 Dans le cas où une demande de délivrance ou de modification d’une licence d’établissement qui contient, conformément aux paragraphes C.01A.005(2) ou C.01A.006(1.1) du Règlement sur les aliments et drogues, une mention faisant référence à la COVID-19 est présentée au ministre avant la date d’entrée en vigueur des paragraphes 8(2) et 9(2) du présent règlement, le ministre peut délivrer ou modifier la licence au titre de cette demande à cette date ou après celle-ci, malgré les modifications apportées par ces paragraphes.
41 (1) Le paragraphe C.08.002(2.01) du Règlement sur les aliments et drogues ne s’applique pas à l’égard de la présentation de drogue nouvelle qui a été déposée avant la date d’entrée en vigueur de ce paragraphe.
(2) Le paragraphe C.08.003(3.01) du Règlement sur les aliments et drogues ne s’applique pas à l’égard du supplément à une présentation de drogue nouvelle qui a été déposé avant la date d’entrée en vigueur de ce paragraphe.
42 (1) Si, à la date d’entrée en vigueur du paragraphe 16(1) du présent règlement, le ministre n’a pas rendu de décision définitive en application de l’article C.08.004 du Règlement sur les aliments et drogues à l’égard de la présentation de drogue nouvelle déposée avant cette date conformément aux paragraphes C.08.002(2) à (2.5) et à l’article C.08.005.1 de ce règlement à l’égard d’une drogue désignée contre la COVID-19 au sens de l’article C.08.001.1 du même règlement, dans sa version avant cette date, les paragraphes C.08.002(2) à (2.5), dans leur version antérieure à cette date, continuent de s’appliquer à l’égard de la présentation jusqu’à ce que le ministre rende une décision définitive.
(2) Si, à la date d’entrée en vigueur du paragraphe 16(3) du présent règlement, le ministre n’a pas rendu de décision définitive en application de l’article C.08.004 du Règlement sur les aliments et drogues à l’égard de la présentation de drogue nouvelle déposée avant cette date conformément aux paragraphes C.08.002(2) à (2.5) et à l’article C.08.005.1 de ce règlement à l’égard d’une drogue d’urgence de santé publique au sens de l’article C.08.001.1 du même règlement, dans sa version avant cette date, relative à la COVID-19, la drogue demeure une drogue d’urgence de santé publique pour l’application du titre 8 de la partie C du même règlement jusqu’à ce que :
- a) le ministre rende sa décision définitive;
- b) dans le cas où la COVID-19 est décrite dans la Liste d’affections qui menacent la santé publique au sens de l’article C.08.001.1 du même règlement au moment où le ministre rend sa décision définitive, la COVID-19 soit retirée de cette liste.
43 (1) Si, à la date d’entrée en vigueur du paragraphe 18(7) du présent règlement ou avant celle-ci, le ministre indique au fabricant d’une drogue nouvelle pour usage vétérinaire seulement qui a déposé, à l’égard de cette drogue, une présentation de drogue nouvelle qui ne contient pas encore l’ensemble des renseignements et du matériel à y inclure son intention d’examiner la présentation avec une autorité réglementaire étrangère, le fabricant lui fournit, au plus tard soixante jours après cette date, un plan précisant les modalités selon lesquelles il lui fournira les renseignements ou le matériel manquants, à moins qu’il lui ait fourni un tel plan à cette date ou avant celle-ci.
(2) Si, à la date d’entrée en vigueur du paragraphe 21(3) du présent règlement ou avant celle-ci, le ministre indique au fabricant d’une drogue nouvelle pour usage vétérinaire seulement qui a déposé un supplément à la présentation de drogue nouvelle déposée à l’égard de la drogue qui ne contient pas encore l’ensemble des renseignements et du matériel à y inclure son intention d’examiner le supplément avec une autorité réglementaire étrangère, le fabricant lui fournit un plan précisant les modalités selon lesquelles il lui fournira les renseignements ou le matériel manquants au plus tard soixante jours après cette date, à moins qu’il lui ait fourni un tel plan à cette date ou avant celle-ci.
44 Les conditions dont toute homologation visée au paragraphe 36(1) du Règlement sur les instruments médicaux est assortie avant la date d’entrée en vigueur de l’article 34 du présent règlement sont réputées être imposées par le ministre en vertu du paragraphe 36(2) du Règlement sur les instruments médicaux, dans sa version à cette date.
Entrée en vigueur
45 (1) Sous réserve des paragraphes (2) et (3), le présent règlement entre en vigueur le jour de son enregistrement.
(2) Les dispositions ci-après entrent en vigueur au premier anniversaire de l’enregistrement du présent règlement :
- a) les articles 4 et 5;
- b) le paragraphe 6(4);
- c) l’article 7;
- d) les paragraphes 18(2), (5) et (7);
- e) les articles 19 et 20;
- f) les paragraphes 21(1) et (3);
- g) l’article 23;
- h) les articles 34 et 35.
(3) Les dispositions ci-après entrent en vigueur à la date fixée par modification du présent paragraphe :
- a) les paragraphes 8(2), 9(2) et 10(2);
- b) le paragraphe 16(3);
- c) les paragraphes 18(4) et (6).
Conditions d’utilisation et Avis de confidentialité
Conditions d’utilisation
Vous êtes tenu de vous assurer que les commentaires que vous formulez ne contiennent aucun des éléments suivants :
- renseignement personnel;
- renseignement protégé ou classifié du gouvernement du Canada;
- commentaire discriminatoire ou qui incite à la discrimination fondée sur la race, le sexe, la religion, l’orientation sexuelle ou contre tout autre groupe protégé en vertu de la Loi canadienne sur les droits de la personne ou de la Charte canadienne des droits et libertés;
- commentaire haineux, diffamatoire ou obscène;
- commentaire menaçant, violent, intimidant ou harcelant;
- commentaire venant à l’encontre des lois fédérales, provinciales ou territoriales du Canada;
- commentaire qui constitue une usurpation d’identité, de la publicité ou du pollupostage;
- commentaire dont le but est d’encourager ou d’inciter une activité criminelle;
- commentaire rédigé dans une langue autre que le français ou l’anglais;
- commentaire qui contrevient autrement au présent avis.
L’institution fédérale qui gère le changement réglementaire proposé conserve le droit d’examiner et de supprimer les renseignements personnels, les propos haineux ou tout autre renseignement jugé inapproprié à la publication, tel qu’il est décrit ci-dessus.
Les renseignements commerciaux confidentiels ne doivent être affichés que dans la zone de texte réservée à cette fin. En général, « renseignements commerciaux confidentiels » désigne les renseignements qui i) ne sont pas accessibles au public, ii) sont traités de façon confidentielle par la personne dont l’entreprise est concernée par ces renseignements et iii) ont une valeur économique réelle ou potentielle pour la personne ou ses concurrents, car ils ne sont pas accessibles au public et leur divulgation entraînerait une perte financière pour la personne ou un gain important pour ses concurrents. Les commentaires fournis dans la zone réservée aux renseignements commerciaux confidentiels qui correspondent à cette description ne seront pas rendus publics. L’institution fédérale qui gère le changement réglementaire proposé conserve le droit de rendre le commentaire public s’il n’est pas considéré qu’il s’agit d’un renseignement commercial confidentiel.
Vos commentaires seront affichés sur le site Web de la Gazette du Canada à la disposition du public pour examen. Cependant, vous avez le droit de soumettre vos commentaires de façon anonyme. Le cas échéant, vos commentaires seront rendus publics et attribués à une personne anonyme. Aucun autre renseignement à votre sujet ne sera rendu public.
Les commentaires seront affichés sur le site Web de la Gazette du Canada pendant au moins 10 ans.
À l’heure actuelle, la fonction de commentaires en ligne ne prend pas en charge les pièces jointes; les zones de texte ne prennent pas en charge les graphiques, les tableaux ou autres éléments multimédias semblables. Si vous devez joindre une pièce jointe à vos commentaires, veuillez écrire à l’adresse de courriel ministérielle indiquée dans l’avis de publication préalable. Veuillez noter que la communication par courriel public n’est pas sécurisée. Par conséquent, si la pièce jointe à transmettre contient des renseignements de nature délicate, veuillez écrire à l’adresse de courriel ministérielle pour discuter des façons dont vous pouvez transmettre ces renseignements.
Avis de confidentialité
Les renseignements fournis sont recueillis en vertu de la Loi sur la gestion des finances publiques, de la Loi sur le ministère des Travaux publics et des Services gouvernementaux, de la Loi de mise en œuvre de l’Accord Canada–États-Unis–Mexique, ainsi que des lois habilitantes des organismes de réglementation concernés, aux fins de recueillir des commentaires liés aux changements réglementaires. Vos commentaires et vos documents sont recueillis dans le but d’accroître la transparence du processus réglementaire et de rendre le gouvernement plus accessible aux Canadiens.
Les renseignements personnels soumis sont recueillis, utilisés, communiqués, conservés et protégés contre l’accès par les personnes ou les organismes non autorisés conformément aux dispositions de la Loi sur la protection des renseignements personnels et du Règlement sur la protection des renseignements personnels. Les noms des personnes fournis ne seront pas affichés en ligne; ils seront toutefois conservés pour que nous puissions communiquer avec ces personnes au besoin. Les noms des organisations qui formulent des commentaires seront affichés en ligne.
Les renseignements soumis, y compris les renseignements personnels, seront accessibles à Services publics et Approvisionnement Canada, à qui incombe les responsabilités de la page Web de la Gazette du Canada, et à l’institution fédérale responsable de la gestion du changement réglementaire proposé.
Toute personne est en droit de demander que les renseignements personnels la concernant lui soient communiqués ou qu’ils soient corrigés. Pour demander l’accès à vos renseignements personnels ou leur correction, communiquez avec le Bureau de l’accès à l’information et de la protection des renseignements personnels (AIPRP) de l’institution fédérale responsable de la gestion du changement réglementaire proposé.
Vous pouvez adresser une plainte au Commissariat à la protection de la vie privée du Canada au sujet de la gestion de vos renseignements personnels par une institution fédérale.
Les renseignements personnels fournis sont versés dans le fichier de renseignements personnels POU 938 Activités de sensibilisation. Les personnes qui souhaitent accéder à leurs renseignements personnels en vertu de la Loi sur la protection des renseignements personnels doivent en faire la demande à l’organisme de réglementation compétent en fournissant suffisamment de renseignements pour permettre à l’institution fédérale de récupérer les renseignements personnels concernant ces personnes. L’institution fédérale pourrait avoir de la difficulté à retracer les renseignements personnels au sujet de personnes qui formulent des commentaires de façon anonyme et qui demandent l’accès à leurs renseignements personnels.